急性早幼粒细胞白血病
| A+医学百科 >> 肿瘤 >> 急性早幼粒细胞白血病 |
急性早幼粒细胞白血病(acute promyelocytic leukemiaAPL)是急性髓细胞白血病(AML)的一种特殊类型,被FAB协作组定为急性髓细胞白血病M3型。
目录 |
概述
急性早幼粒细胞白血病(acute promyelocytic leukemiaAPL)是急性髓细胞白血病(AML)的一种特殊类型,被FAB协作组定为急性髓细胞白血病M3型。
造血组织的恶性疾病。其特点是骨髓及其他造血组织中有大量白血病细胞无限制地增生,并进入外周血液,而正常血细胞的制造被明显抑制,该病居年轻人恶性疾病中的首位,病因至今仍不完全清楚,病毒可能是主要的致病因子,但还有许多因素如放射、化学毒物(苯等)或药物、遗传素质等可能是致病的辅因子。根据白血病细胞不成熟的程度和白血病的自然病程,分为急性和慢性两大类。
分型
发病急,骨髓和外周血中主要是原始细胞,若不治疗病人常于半年内死亡。根据白血病细胞的类型,临床上又分为急性淋巴细胞性白血病(ALL) 和急性非淋巴细胞性白血病(ANLL)两大类,每类又有几型。目前国内外通用的分型如下:
ANLL分为7型
即粒细胞白血病未分化型(M1) 、 粒细胞白血病部分分化型 (M2)、 早幼粒细胞型(M3)、粒-单核细胞型(M4)、单核细胞型(M5)、红白血病(M6)、巨核细胞型(M7);
ALL分为L1 、L2和L3型
近年来又根据细胞的免疫学特点分为T、 B、前B、普通型和未分化型。病人常突然发生贫血、感染和出血及肝脾、淋巴结肿大和胸骨压痛,血常规和骨髓检查可确定诊断。近年来疗效有较大提高,有些病人已治愈,除输血和抗感染等对症支持治疗外,联合化疗是当前主要的治疗方法,由于新的有效化疗药物的不断涌现和联合用药方法的改进,完全缓解率已达80%以上;另外分化诱导剂维甲酸等可使早幼粒白血病细胞分化诱导成熟,疗效显著,是近年来的重要发现;骨髓移植可获痊愈,但仍有一些问题尚待解决。
流行病学
急性早幼粒细胞白血病在临床上并不少见,病人常较年青年龄中位数30~38岁10岁以下者罕见据中国完全统计M3的发病率高于西方国家的10%左右,占同期AML的18.7%有的地区如东北油田M3的发病率在AML中可能高达20%~30%,甚至更高,国外资料显示,欧洲中南美洲的拉丁裔民族发病率较高APL约占成人原发性AML的10%~15%,不过也可存在年龄和种族的差异。
病因
原发性APL的病因目前尚未完全清楚继发者常见于应用化疗和(或)放疗的肿瘤患者,也有应用烷化剂和拓扑异构酶Ⅱ抑制剂引起APL的报道继发性APL的预后较好,其对治疗的反应和长期生存率与原发者相近,但与化疗相关的AML明显不同。
特点
① 早幼粒细胞浆内充满异常颗粒;
② 常伴有出血倾向发生率达72%~94%,严重者出现DIC;
③ 90%的患者出现特异性染色体t(15;17)(q22;q21)改变;
④ 对化疗敏感,但早期死亡率高,尤其在甲细胞毒细胞药物化疗时,约有10%~20%患者死于时期出血;
⑥ 持续缓解时间较长。以往APL的治疗效果很差预后凶险,多因并发性弥散性血管内凝血(DIC)或原发性纤维蛋白溶解导致严重出血,而早期死亡近年来随着对APL细胞生物学的特性认识的不断提高和治疗方法改进,使治疗结果和预后得到了很大的改善早期死亡率明显下降
发病机制
APL是白血病中对诱导分化治疗反应较好的一种类型,这与APL细胞中表达的维A酸受体(RARα)融合蛋白诱导的染色质的改变有关。已报道的APL的5种染色体易位均累及17号染色体上的RARα基因。该基因全长39398bp包含9个外显子和8个内含子。t(15;17)易位见于绝大多数APL患者,维A酸受体α基因与15号染色体的早幼粒细胞白血病(PML)基因形成PML-RARα融合基因该融合基因编码的蛋白具有不同于正常RARα等位基因编码的野生型维A酸受体的功能RARα基因位于染色体17长臂2l区带其功能是核激素受体。维A酸结合在RAR受体元件上转录调节许多基因。PML是一核蛋白从氨基端到羧基端包括脯氨酸丰富区、核小体定位所需的胱氨酸丰富区形成同/异二聚体所需的螺旋环螺旋结构核定位信号NLS以及丝氨酸、脯氨酸丰富区。PML正常位于一个称为POD(PML oncogenic domain)的结构(又称核小体多蛋白核器)中。POD在核中呈斑点状数目15~20个PML的功能尚未完全阐明。近来的研究认为PML通过转录共激活作用,具有抑制肿瘤生长的活性,在多种凋亡途径中PML也可能起重要作用。在M3型AML(急性早幼粒细胞白血病)中,17号染色体上的RARα与15号染色体上的PML相互易位即发生t(15;17)(q22;q21)PML和RARα的相互易位造成以下后果:
① PML-RARα融合蛋白通过显性负抑制作用抑制早幼粒细胞分化成熟;
② PML去定位形成上百个细小颗粒分布在核及胞质中使POD的结构破坏,PML的正常抑制增殖和促凋亡功能发生障碍导致细胞增殖,凋亡减少;
③ RARα正常时能与转录共抑制复合物(N-CoR/Sin3a/HDAC-1)(N-CoR=核受体共抑制物,HDAC=组蛋白去乙酰化酶)结合在生理剂量的维A酸作用下RARα可以与共抑制复合物解离,起转录激活作用,即激活所调节的靶基因PML-RARα可促进RARα与共抑制复合物的结合抑制RARα所调节的靶基因抑制了早幼粒细胞的分化成熟并使其增殖引起M3型AML在治疗剂量下ATRA可降解PML-RARα此外ATRA还可使共抑制复合物与RARα分离进而募集共激活(coactivators)复合物,包括CBP/P300、P/CAF、NcoA-1/SRC-1P/CIF等蛋白其中CBF/P300和P/CAF有强烈的组蛋白乙酰化酶活性,使组蛋白乙酰化组蛋白乙酰化后,转录激活靶基因的功能恢复早幼粒细胞乃分化成熟。
1%~2%的APL有变异型t(11;17)(q23;q21)使11号染色体上的早幼粒细胞白血病锌指基因(PLZF)与位于17号染色体上的RARα基因融合。迄今报道的所有患者体内同时表达PLZF-RARα和RARα-PLZF两种融合蛋白提示t(11;17)(q23;q21)APL发病可能需要RARot-PLZF融合蛋白发挥相应的作用t(11;17)(q23;q21)APL对ATRA不敏感更少见的变异性染色体易位有t(5;17)(q35;q21)导致NPM(nucleophosmin)与RARα基因融合;t(11;17)(q13;q21)产生NuMA-RARα融合基因;dup(17)(q21.3-q23)产生STATSb-RARα融合基因。前2种易位的患者对ATRA敏感,但ATRA对STAT5b-RARα融合基因阳性患者无效。
APL融合基因的致白血病作用已在转基因动物模型得到证实。hMRP8或人组织蛋白酶G(human cathepsin G)微基因调控下表达PML-RARα的hCG-PML-RARα转基因小鼠在出生后约1年发生APL样白血病,而hCG-PLZF-RARα转基因小鼠在出生后3~12个月发生慢性粒细胞白血病样病变,伴骨髓内早幼粒细胞增多;而同时表达PLZF-RARα和RARα-PLZF的转基因小鼠才发生类似人类的APL;NPM-RARα转基因小鼠在出生后1年出现典型APL或慢性粒细胞白血病样病变。
临床表现
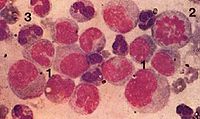
早幼粒细胞白血病(M3)骨髓片
急性早幼粒细胞白血病的临床表现正常骨髓造血功能衰竭相关的表现如贫血、出血感染;白血病细胞的浸润有关的表现如肝脾和淋巴结肿大骨痛等除了这些白血病具有的一般白血病表现外出血倾向是其主要的临床特点,有10%~20%的患者死于早期出血,弥漫性血管内凝血(DIC)的发生率高大约60%的患者发生DIC。
并发症
感染
是最常见的并发症 包括细菌病毒真菌感染主要表现为发热,感染的部位常见于口腔肺部皮肤严重者可出现败血症、感染中毒性休克。
DIC是APL
最重要的并发症 发生率高大约60%的患者发生。近年随着应用甲酸和砷剂,DIC的发生已明显减低。
高白细胞症
在应用维A酸治疗过程中会合并高白细胞症,维A酸综合征,可同时给予羟基脲小剂量Ara-C或减量的AADA方案治疗。
诊断
根据FAB的形态学诊断标准确立诊断。按FAB分型急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)又称AML-M3型。其典型特征有:
① 骨髓形态为胞质含粗大颗粒和Auer小体(也有微颗粒变异型)的异常早幼粒细胞增生;
② 临床常有严重出血且易合并DIC和纤维蛋白溶解;
③ 90%的患者显示特异性染色体异位t(15;17);
④ 化疗敏感(化疗耐药发生率<5%),缓解生存期长但早期死亡率高。
鉴别诊断: 主要与其他类型的白血病鉴别其鉴别要点根据细胞形态学、细胞免疫学检查细胞遗传学检查,一般不难鉴别。
检查
基本检查
1、外周血 典型的血象显示贫血,白细胞数量的变化,并可见幼稚细胞,血小板减少。
2、骨髓像 以异常的颗粒增多的早幼粒细胞增生为主>30%,多数>50%,且细胞形态较一致,原始细胞以下
各阶段细胞较少,细胞核形态多不规则有内外浆,外浆中无颗粒,内浆中有大小不均的颗粒根据颗粒的大小可分为:
M3a(粗颗粒型):胞质中充满粗大的嗜苯胺蓝颗粒,且密集融合分布,颗粒也可以覆盖在校上。
M3b(细颗粒型):胞质中嗜苯胺蓝颗粒细小,而密集分布。
3、细胞免疫学检查 蛋白标CD33,13(HLA-Dr阴性)。
4、细胞遗传学检查 染色体异常,t(15;17)(q22;q21)。
5、出凝血时间、3P试验、纤维蛋白原含量、纤溶酶原含量及活性ATPP(活化部分凝血活酶时间)、PT(凝血酶原时间)。
其它辅助检查
根据病情、临床表现、症状、体征选择X线CT、MRI、B超心电图等检查。
治疗
1、APL 是急性白血病中病情十分凶险的一种类型,其出血症状是十分常见的,发生率达72%~94%,明显高于其他急性白血病,往往是弥散性血管内血(DIC)的表现尤其是在化疗过程中DIC可以加重,常致患者早期死亡由于APL有其独特的染色体异常即t(15;17),产生融合基因PML-RARα及其编码的蛋白故其治疗与其他AML有所不同随着近阶段对APL的研究进展使得其治疗成为白血病治疗最成功的范例之一早在20世纪70年代就已明确,APL对蒽环要药物非常敏感,单独应用化疗的治疗效果优于AML的其他类型,维A酸(ATRA)和砷剂的出现使APL的疗效发生了极大的改观在诱导治疗的同时,给予积极的支持治疗也十分重要,包括抗感染输血小板、输血等。
诱导分化治疗
在维A酸(ATRA)临床应用之前体外实验证实维A酸(ATRA)能诱导白血病细胞株(如HL-60细胞)和APL原代细胞分化。1986年中国学者在国际上首次使用全反式维A酸诱导分化治疗APL并获得了成功目前维A酸(ATRA)诱导分化疗法主要用于APL,并已开始尝试于其他类型的AML及一些实体瘤维A酸对肿瘤细胞的作用机制与化疗药物不同,它通过促进APL细胞的分化纠正出凝血机制的异常,避免化疗所致的骨髓抑制和诱发DIC的可能,使白血病的治疗出现了重大的突破,使APL的预后大为改观。
① 维A酸(ATRA)的用法和疗效:
A、一般剂量:维A酸(ATRA)治疗APL的一般剂量为45mg/(m2.d)分次口服疗程30~45天对初治APL患者,维A酸(ATRA)的CR率可达90%左右(表1)。
B、小剂量:小剂量维A酸(ATRA )15~25mg/(m2.d)分次口服治疗APL以减轻维A酸的毒副反应结果表明小剂量治疗可达到一般剂量的CR率。然而在降低维A酸(ATRA)毒副反应方面的报告不尽一致。Castaigne等分别以25mg/m2与15mg/m2 维A酸(ATRA)治疗APL结果认为在疗效、激发高白细胞症维A酸综合征和药代动力学方面两组之间无明显差异。
② 诱导期治疗方法的改进:一般主张在维A酸(ATRA)治疗中合并化疗,待白细胞已升至3×109/L以上应用化疗,这样既可防止维A酸综合征的发生又可提高CR率,延长CR期国内孟氏报道,服用维A酸(ATRA )15天后改用化疗治疗APL是安全的。欧洲协作组对93例白细胞数低于5×109/L的初发APL的研究显示,先维A酸(ATRA后化疗和维A酸(ATRA)+化疗的两组病人临床完全缓解率无区别但维A酸(ATRA)+化疗一组病人2年内的复发率显著低于先维A酸(ATRA)后化疗组。表明维A酸(ATRA)与化疗同时使用更能发挥化疗对维A酸( ATRA)的补充作用并降低复发率意大利协作组用维A酸(ATRA )45mg/m2诱导治疗的第6~8天同时予DA 12mg/(m2.d),完全缓解率高达92%。另外有些病例单纯应用ATRA不能控制病情,也可加用小量的阿糖胞苷(Ara-C)或减量的AADA方案。
单用维A酸(ATRA)诱导和维持治疗患者的主要问题是早期复发,中位CR期仅5个月。此时产生ATRA耐药和白血病复发的主要原因可能是长期使用维A酸(ATRA)使血浆中生成ATRA代谢酶,以致维A酸(ATRA)的血药浓度下降不足以维持白血病细胞继续分化成熟;或白血病细胞在维A酸(ATRA)诱导下合成ATRA结合蛋白从而阻止药物进入细胞核发挥诱导分化作用不少作者发现在始终单用ATRA治疗的缓解患者中大都PML-RARα融合基因表达持续阳性且其表达与白血病复发高度相关但若加用化疗则可使PML-RARα表达转阴患者的缓解生存期也显著延长。因此尽管使用维A酸(ATRA)治疗已经获得高CR率,化疗对APL的长期缓解乃至治愈依然是必不可少的。
然而诱导缓解治疗采用维A酸(ATRA)也有助APL延长缓解。表2摘要介绍国外作者报道的APL治疗效果:患者诱导缓解使用维A酸(ATRA)±化疗,缓解后均用化疗巩固强化,结果显示各家报道的EFS,凡在诱导化疗时采用维A酸(ATRA)+化疗组都明显优于同期或历史对照的单用化疗组这说明维A酸(ATRA)能增加APL对化疗的敏感性明显减少本病复发两者相辅相成。
③ 缓解后治疗:维A酸(ATRA)联合应用化疗能显著改善病人的预后上海血液病研究所对一组(70例)用DA或HA,维A酸(ATRA)巯嘌呤(6-MP)+甲氨蝶呤(MTX)序贯治疗的回顾性研究表明,平均5年无病生存率为70%±6%另一项回顾性研究表明,64例联合应用维A酸(ATRA)和化疗的病人5年无病生存率为58.5%±10.4%,而另一组(47例)单用化疗的病人只有26.7%±9.4%Tallman等开展的前瞻性研究也证实了这一点即诱导缓解和强化巩固时都使用维A酸(ATRA)的病例疗效好于单用化疗者。在有效预防AT-RA综合征的基础上联合化疗90%的初发病人都得到缓解而单用化疗即使在初发病人缓解率也很难达到80%。法国Fenaux等报告一组54例APL用维A酸(ATRA)治疗,CR率90%,以后用强化疗巩固,2年无事件生存(event free survival,EFS)率68%,生存率81%。日本成人白血病研究组于1995年报道109例APL予维A酸(ATRA)或维A酸(ATRA)加化疗取得CR后(89%),予化疗巩固23个月的EFS为75%(66%~83%)取得CR的DFS为81%(7l%~91%)一般主张缓解后应该使用化疗及维A酸交替应用的方案。
④ APL变异型治疗:APL除有典型的t(15;17)易位外还有一种少见的变异型易位t(11;17)(q23;q21),该变异型易位占APL的1%~2%它使RARα与另一转录因子PLZF(promyelocytic leukemia zincfinger)基因融合。t(11;17)的患者对ATRA诱导分化疗法或化学疗法反应均较差或无效其白血病细胞在体外培养时经ATRA处理不发生分化。该类患者对维A酸(ATRA)+G-CSF或维A酸(ATRA)+化疗治疗有效;另一种变异型易位t(11;17)(q13;q11)发生率更少累及的融合基因为NuMA- RARα该型ATRA治疗有效。M3的另一变异型易位t(5;17)(q32;q21)累及5号染色体上的核磷酸蛋白(nucleophosmin,NPM)基因。形成NPM-RARα融合基因,这类患者维A酸(ATRA)治疗有效。
⑤ 维A酸(ATRA)的副反应:包括口唇及皮肤干燥(70%~90%)、头痛(25%~40%)骨关节痛(15%~30%)肝功能受损和血脂增高(12%~30%)等。有2/3~3/4的患者发生不同程度的白细胞升高最严重的并发症是维A酸综合征和血栓形成前者表现为发热、胸闷、呼吸困难水潴留伴水肿、胸腔或心包积液高血压、呼吸窘迫缺氧呼吸功能衰竭,少数肾功能衰竭。常发生在高白细胞的患者发生率10%~25%是致死原因。合用化疗后这种严重并发症已降至5%~7%治疗方法是大剂量地塞米松静脉注射10mg/次2次/d共3~5天。
⑥ 治疗机制:维A酸(ATRA)诱导分化治疗APL的机制尚未完全阐明由于维A酸(ATRA)受体α、β、γ的发现以及它们结构与功能的进一步阐明,维A酸(ATRA)作用机制的研究,才得到了很大的发展据已有资料结合国内的研究结果可归纳为以下几方面:维A酸(ATRA)在诱导分化的同时改变APL细胞的生物学性质,解除其对骨髓造血细胞的抑制作用;APL的特异融合蛋白PML/RARα在ATRA的作用下降解PML的分布恢复正常,RARαRARX的正常功能以及原受PML/RARα抑制的早幼粒细胞分化得以恢复;维A酸(ATRA)促进APL细胞凋亡;维A酸(ATRA)上调下列蛋白和基因RARα、RARβ、IRF-2STATlaSTATlbSTAT2、RIG-E、FGH、I、IL-lbG-CSF受体、GM-CSF受体、CD11cCD11bCDl5CD18、CD45RO、蛋白激酶C组织谷氨酰转移酶鸟氨酸脱羧酶碱性磷酸酶、尿激酶型纤溶酶原活化剂、MCP-1IFN-α纤溶酶活化剂抑制物(PAI)。相反aATRA下调下列蛋白和基因:组织因子肿瘤促凝物质、组织因子连接素ⅧC-MYCCD33端粒酶活性、BCL-2、PARP(多聚ADP核糖聚合酶)、组织弹力酶G弹性蛋白酶髓过氧化物酶、CD45RA抗原由此可见,维A酸(ATRA)的作用涉及范围甚广,有的直接影响维A酸(ATRA)的结合和作用,如与RARα结合;有的与早幼粒细胞的功能有关如一些酶的改变;有的涉及出凝血,如组织因子肿瘤促凝物质的下调可解释为何在维A酸(ATRA)诱导分化过程中,DIC改善;有的基因与信号传导密切有关,如STAT、PKC;不少基因的改变可阐明维A酸(ATRA)的促凋亡作用,如BCL-2、PARP的下降。G-CSF、GM-CSF受体的上调可解释维A酸(ATRA)治疗过程中白细胞增高的原因上海血液病研究所研究发现,由维A酸(ATRA)诱导上调的一些基因(RIG-E,FGHI)虽然已初步阐明它们的性质如RIG-G与干扰素刺激基因(ISG)中的一个家族有很高的同源性和相同的染色体定位RIG-E与某些受体如EGFR(上皮生长因子受体),LDL-RuPAR等有一定的同源性,但它们在维A酸(ATRA)诱导分化治疗APL中的确切机制,尚待进一步阐明。
砷剂治疗
① 诱导缓解:维A酸(ATRA)治疗初治APL虽可取得很高的缓解率,但多数病例易产生耐药性复发后再用维A酸(ATRA)治疗,效果较差自20世纪70年代初期哈尔滨医科大学用以砷剂为主要成分的“癌灵1号”治疗APL,取得较好疗效。诱导缓解治疗方案:成人0.1% As2O3注射液10ml/d,加入5%葡萄糖液250~500ml中静脉滴注3~4 h,儿童可按6mg/m2计量,4周为1个疗程每疗程可间歇5~7天也可连续用药2个疗程病情无缓解为无效。
1995年黄世林等报道,应用含巯化砷的中药复方青黛片治疗初治APL的结果。方案如下:口服复方青黛片,每天15片(0.25g/片),一周后逐渐加量至每天30片,持续用药30~60天,CR率可达98.3%。1998年2月起陆道培等应用中等纯度As4S4(TATS)治疗APL,方法为:口服0.5g每天3次,持续2~4周休息2~3周,共维持3~4年后又开展了高纯度TATS的临床应用方法为:1g3次/d直至CR休息2~3周第4年休息间隔时间可延长至4~6周应用TATS后,血浆砷浓度于第15天达高峰(40~104mcg/L),停药2周后血浆砷浓度降至<2~22mcg/L(平均15mcg/L),停药30天后平均血浆浓度为3mcg/L。
A、As2O3治疗APL的适应证:
a、初治APL特别是t(15;17)或PML-RARα融合基因阳性者
b、维A酸(ATRA)或联合化疗治疗无效的难治或复发的APL
c、不能耐受或不宜应用维A酸(ATRA)或联合化疗的APLd.APL CR后巩固维持治疗。
e、伴有异常早幼粒细胞增多的其他类型白血病(慢性粒细胞白血病急变、ANLL M2M4、M6型)及MDS等。
不宜选用As203治疗的APL:有非白血病本身所致的严重肝、肾功能障碍者;用As2O3巩固治疗复发者;有砷中毒表现者。
B、毒副反应:急性毒副反应主要有液体潴留(胸腔积液、心包积液、体重增加),短期使用利尿剂有效,用地塞米松无明显疗效约20%的患者可出现消化道反应表现为恶心呕吐、腹痛、腹泻、食欲下降10%的患者有不同程度的手足麻木、颜面水肿。常规剂量下20%~30%的患者可能出现不同程度的肾功能异常,但停药后1~2周大多恢复正常。对肝脏,在原有慢性肝炎的病例易诱发肝细胞坏死,引起肝功能衰竭。心电图可出现窦性心动过速Ⅰ~Ⅱ度房室传导阻滞完全性房室传导阻滞及各种室性心律失常。必须指出,砷剂治疗过程中也有2/3的患者白细胞升高,有10%~15%的患者并发类似维A酸综合征其临床表现及处理与维A酸治疗时发生的相同。部分患者出现有慢性副作用表现为皮肤色素沉着、掌角化病多神经病(感觉运动神经功能均受损),肌肉萎缩。剂量>0.2mg/(kg.d)时可出现弛缓性麻痹肾衰等严重副作用。慢性As203中毒不仅取决于所用的量而且取决于个体的易感性当出现砷剂严重中毒时可用药物来减轻其副作用,如二巯基丙磺酸钠(2,3-二巯基磺酸丙烷)等。
C、砷剂治疗APL的机制:形态学上可见细胞核染质固缩形成凋亡小体。体外研究发现低浓度砷剂(0.1μmol/L)对NB4细胞有诱导分化作用在高浓度下(>0.5~1μmol/L),砷剂诱导凋亡。DNA分析,在细胞流式仪检测中可见G1峰前出现凋亡峰DNA电泳示典型的凋亡梯形改变细胞及分子生物学研究结果显示,As2O3可使PML/RARα融合蛋白降解BCL-2基因下调,对BAX基因无作用。以上结果提示As2O3治疗APL的作用机制可能主要是诱导APL细胞凋亡,低浓度诱导分化此外砷剂作用中的一些分子机制包括:
a、丝裂原激活的蛋白激酶(cMAPK)信号通道与应激相关的JNK/SAPK(应激激活蛋白酶)和P38激酶被激活,导致凋亡。
b、砷剂使线粒体膜上的PT(通透性改变)孔通透性增高,致线粒体内AIF及细胞色素C释放至线粒体外。
c、对G1/S及G2/M起作用,使细胞周期延长。
d、三价砷可诱导红白血病细胞的鸟氨酸脱羧酶(ornithine decarboxylase,ODC)活力改变,影响多胺的合成抑制肿瘤生长。
② APL完全缓解后砷剂治疗:应用常规剂量As2O3,每疗程2~3周As2O3应用间歇期在CR后第12、3及3年后分别为123或4及6个月;也可将As203与联合化疗(HA、DA或Am-C+米托蒽醌(NVT)/依托泊苷(VP-16)交替进行间歇期同上。
ATBA联合As203治疗APL
维A酸(ATRA)治疗APL可取得80%~90%的完全缓解率(CR)与典型的细胞毒药物相比维A酸(ATRA)能够改善APL患者的凝血障碍而不引起骨髓抑制然而维A酸(ATRA)可能引起致死性的药物相关综合征,同时单用维A酸(ATRA)维持治疗常引起白血病的复发,因而限制了其应用As203不但能诱导初治APL取得CR,还可诱导经细胞毒药物、维A酸(ATRA)等治疗后复发的患者达到90%的CR体外实验证明As2O3的作用机制与维A酸(ATRA)不同,能引起白血病细胞发生凋亡维A酸(ATRA)联合As203对APL细胞系与新鲜APL细胞作用的研究表明,两种药物联合具有协同促分化作用,也可促进耐药细胞对药物的敏感性上海血液病研究所应用维A酸(ATRA )25mg/(m2.d)As203 0.16mg/(kg.d)联合治疗初发的APL直至CR。结果显示31例患者早期死亡2例29例获CRCR率为93.5%获得CR的平均时间为(25.1±3.9)天66.5%的患者治疗后白细胞升高65.5%出现肝功能异常,但减量或停用1周内恢复。至CR时10.3%的PML/RARα转阴巩固治疗后77.0%转阴。
造血干细胞移植(HSCT)
初发病例用维A酸(ATRA)联合化疗CR可达70%~80%且大部分患者在首次复发后应用As203或再次应用维A酸(ATRA)与化疗等,还可获得较高的二次缓解率(CR2),因此一般认为首次缓解的患者并不主张行HSCT
治疗尽管目前的治疗方法可使APL获得较高的缓解率,但复发率仍达25%,对于这些患者自体或异基因干细胞移植不失为一种挽救的治疗方法。在临床应用维A酸(ATRA)之前,HSCT可使45%的二次缓解的患者治愈最近的研究显示二次缓解后应用自体移植效果非常好,可减少白血病的复发使无病生存率超过70%。国内外报告表明CR后骨髓移植3年DFS在77%~80%以上,优于单化疗或化疗合并维A酸(ATRA)的CR后治疗方案鉴于APL缓解患者使用化疗、维A酸以及砷剂,5年生存率可达50%~70%,并且考虑到治疗相关死亡率因而本病第一次完全缓解后不一定需要进行HSCT治疗,主要适用于复发患者或PML-RARα融合基因长期持续阳性的患者。不过尽管存在15%~20%的移植相关死亡率异基因HSCT对于二次或多次缓解的患者仍是一种重要的治疗选择对年青和不能达到遗传学缓解的患者,如果有合适的供者,也应选择HSCT治疗。
新的治疗方法
① 脂质体维A酸(ATRA):目前临床上的维A酸(ATRA)仅使用口服制剂,最近一种静脉使用的脂质体维A酸(ATRA)已开发出来该制剂适宜不能吞咽或吸收的患者及儿童患者,可克服这些患者口服所致血药浓度的不稳定。脂质体维A酸(ATRA)的最大耐受剂量为140mg/m2,90mg/m2的剂量可安全有效地使初发及复发的APL患者达到缓解。所以尽管口服制剂易于使用脂质体维A酸(ATRA)仍可能成为一种方便的替代品。
② 组蛋白去乙酰化酶抑制剂:许多基因的转录活性由组蛋白的乙酰化状态所决定;组蛋白的乙酰化状态由组蛋白乙酰基转移酶(HATs)和组蛋白脱乙酰化酶(HDACs)调节。HDACs抑制剂具有促分化、抗增殖和凋亡的作用,主要包括有丁酸盐、曲古抑菌素、苯甲酰胺、环状多肽等这些成分与维A酸(ATRA)联用具有明显的抗白血病作用。
③ 单克隆抗体:HuM195是一种人源化的抗CD33单克隆抗体已成功地用于经过维A酸(ATRA)和(或)化疗达到血液学缓解、PCR阳性的APL微小残留病变的治疗。HuM195可与131I90Y和213Bi连接其临床治疗作用尚待观察另外一种人源化的抗CD33单克隆抗体与calicheamicin(CMA676Mylotary)结合的分子已开发出来这种单抗已被FDA批准用来治疗复发的AML初步的结果显示它可控制具有分子生物学复发证据的APL患者的微小残留病变。
中药对治疗的效果
去年7月份,《自然》杂志发表文章指出,对科学家来说,中药是如此地“难以下咽”,中药仍然笼罩在知其然不知其所以然的神秘面纱下。借助于典型的还原法,研究人员希望寻找出治疗特定疾病的中药配方中的某种关键组分,但类似青蒿素的成功例子少而又少。文章呼吁用一种全新的科学方法来研究中药。
仅仅半年多之后,今年3月14日,陈竺院士领导的团队在《美国国家科学院院刊》(PNAS)发表一篇论文,对中药方剂复方黄黛片治疗急性早幼粒性白血病的分子机理做了系统分析,用生物化学的方法,从分子水平阐明了一个完全依据中医理论研发出来的中药复方黄黛片治疗白血病的多成分多靶点作用机理,并将中药方剂“君、臣、佐、使”的配伍原则用现代医学的方法阐释得淋漓尽致。
3月17日,全国两会即将结束,被任命为新一届政府卫生部长的陈竺院士,花了近两个小时接受本报记者专访,详细地解释了这项研究及成果,并谈了他对中医药现代化的理解。
中医药可以“说得清道得明”
陈竺作为科学家,最被人称道的研究成果是利用全反式维甲酸、三氧化二砷(砒霜)协同治疗急性早幼粒细胞性白血病(APL)。按照这种方法治疗,可以使病人的5年无病生存率超过90%。APL有望成为第一种可以被治愈的成人急性髓细胞性白血病。
据介绍,急性早幼粒性白血病被认为是最凶险的一种白血病,病人骨髓里积累大量的不成熟的早幼粒细胞,且具有严重的出血症状。该病的病因已经研究得比较清楚,主要是两条染色体易位,即染色体臂断裂后互相交换,在结合点就出现一个的融合基因PML-RARα,它编码一个融合蛋白,最终导致细胞癌变。
一般的血细胞在分裂一定的代数后就会分化成熟,变成具有各种特定结构和功能的细胞。但癌变以后的细胞失去了分化能力,会不停地“疯长”下去。全反式维甲酸正是通过修饰和代谢癌蛋白PML-RARα,使癌细胞重新分化,“改邪归正”,停止“疯长”;三氧化二砷则可以引起这种癌蛋白的降解,使癌细胞发生部分分化并最终进入程序化死亡(凋亡)。
有着西方医学教育背景的陈竺,介绍自己的研究时,总是强调接受了中国传统医学思想的启发。复方协同治疗、以毒攻毒、祛邪扶正、好坏转化……处处闪耀着东方哲学的智慧。这也就不难理解他热衷于用现代分子生物学的方法来阐释中药复方了。
他介绍说,早在急性早幼粒细胞性白血病的分子研究尚未开始、癌蛋白PML-RARα尚未被认识的上世纪80年代,解放军大连210医院的中医专家黄世林教授在辩证与辨病相结合的基础上,设计了由雄黄、青黛、丹参、太子参组成的复方黄黛片。此后,安徽天康药业有限公司按照严格的现代工艺批量生产。近年来一项多中心临床研究,证实了复方黄黛片的疗效,其治疗急性早幼粒性白血病,5年生存率可达87%%。研究还发现,雄黄、青黛、丹参的有效成分分别为四硫化四砷、靛玉红与丹参酮IIA。不过,复方黄黛片在分子水平的作用机理一直未被揭示。
于是,在陈竺院士、陈赛娟院士的领导下,上海交通大学瑞金医院、中科院广州生物医药与健康研究院等多个研究小组,经过4年的研究发现,对于急性早幼粒细胞性白血病的小鼠模型,单独应用硫化砷可延长小鼠的生存期,而三药联合可取得明显强于单独或两药联合产生的治疗效果。在白血病细胞模型中,硫化砷、丹参酮单独应用时可引起白血病细胞一定程度的分化,而三药联合可使白血病细胞发生相当程度的“改邪归正”、分化成熟。
在正常情况下,造血细胞由幼稚到成熟的分化过程中,促进细胞分化的基因、属“正”的因素必须逐渐增高,而抑制细胞分化的基因、属“邪”的因素必须相应减少;在细胞周期的调控方面,促进细胞周期的蛋白“阳”与抑制细胞周期的因子“阴”必须维持平衡。患白血病,“正”往往受到压制而“邪”盛,“阳亢”而“阴虚”。
在分子水平上,三药联合可显著增强由硫化砷引起的对急性早幼粒细胞性白血病的致病性PML-RARα癌蛋白的降解破坏,因此具有“去邪”的作用,硫化砷是“君药”。在药物作用下,促进细胞分化的基因表达明显增高,抑制细胞分化的基因显著降低,丹参酮在其中起重要作用;促进细胞周期的蛋白明显得到压制,而抑制细胞周期的蛋白显著增多,其中靛玉红发挥重要作用,研究证实丹参酮是“臣药”、靛玉红是“佐药”。研究还发现,丹参酮与靛玉红通过增加负责运输硫化砷的水甘油通道蛋白9的含量,促使进入白血病细胞的硫化砷明显增多,因此二者都起到“使药”的作用。复方黄黛片通过联合应用,产生协同效应。
中医药的生命力在于开放和创新
“这是一项十分令人感兴趣、具有高度科学意义的研究,开启了用中药复方原理设计联合治疗方案的范例,势必引起学界的极大关注。”一位药理学国际权威专家对论文给予了如此的肯定。
不少专家认为从分子生物学和生物化学的角度看,这项研究几乎近于无懈可击、堪称“完美”。非常经典地解析和阐明了,一个完全依据中医理论研发出来的中药复方,在细胞和分子水平的明确的作用靶点和机制。而且,每种药物在分子水平的作用与中医对每味药物在复方中的地位和作用的认识竟然呼应得是如此之好,简直令人惊叹!
国际主流科学界也对这一研究成果给予积极评价,如《自然》杂志发表题为“中医药:古老复方的现代新解”的述评,认为这一研究显示了“古老药方的主要成分是如何‘和谐行动’治疗疾病的,对于中国传统医学与现代医学的沟通具有重要意义”;《科学》杂志在对陈竺的访谈中也对该文进行了报道。
而陈竺却认为,这项研究能够获得这样的成果,是非常幸运的!
“我们有合适的物质基础,包括纯化的有效化合物、细胞模型与动物模型等。”陈竺说,“当然最重要的是复方黄黛片有非常好的临床疗效,并且被多中心临床研究所证实,没有这个基础,所有的后续研究都是无源之水。从这一点来看,中医药自身的创新发展还是最重要的。”
中医理论体系的丰富发展和实践能力的提高,是中医发展之本,既要讲创新,更要讲传承。陈竺说:“我支持在中医教育和临床实践中倡导发展‘原汁原味’的中医!”
陈竺认为,中医药的现代化同样需要开放的心态。中医几千年的历史,从来就不是故步自封的历史,其内涵不断丰富和进步。波斯医学的传入,“胡药”与“南药”的引入,都对中医发展有着重要贡献。利用现代科学技术手段与多学科方法研究中医药,对中医发展会起到支撑和促进作用。
近年来,西医正逐渐认识到联合治疗方法的益处,而中医通过近10万种复方倡导联合疗法已有两千五百年的历史了。中药复方虽然在临床实践中取得一定疗效,但是大多数复方的有效成分尚不明了,作用机理也不清楚,造成推广应用受到限制。“在确定临床疗效的基础上,开展机理研究,不仅有利于中医的现代化、国际化,还可以为优化方药配伍提供依据。”
陈竺认为,中医药系统在创新方面,应更加开放,更加善于汲取人类共同智慧的结晶。基因组学、蛋白质组学、代谢组学的最新研究成果,核磁共振、生物电、热成像、基因剔除……所有的物理化学生物学的技术,动物模型,人体成像,不论是什么,都可以拿来为中医药研究所用,而且有关体系都要接受生物医学统计学的严格检验。现代生命科学并不姓“西”!要创造条件,把中国生命科学界的优秀科学家和优秀科研机构,吸引到中医药现代化创新体系中来。
现在系统生物医学为中、西两大医学的汇聚创造了前所未有的机遇和平台,把中医和西医整合在一起,是促进中医现代化的非常好的途径。陈竺期望,中医药在保持自身特色,传承发展的同时,更好地汇聚、融合现代科学技术,从而创造出一个高于传统意义上的中医和西医的全新医学。
急性早幼粒白血病的症状
头晕 乏力 恶心 持续高烧 咳嗽 牙龈出血 牙龈肿痛 牙龈萎缩 眼底出血 心悸 脾大 便血 贫血症状
化疗
主要用全反式维甲酸,三氧化二砷,柔红,阿糖胞苷 VP16联合化疗 缓解率达90%
心态
平常心 别害怕 莫生气 谁体验谁知道 就当作是人生中的插曲 也是历练心智的好机会 相信自己能行
效果
感觉很好 和正常人没区别 基本可治愈 复发了也没关系 还可继续化疗得到缓解.
预后
以往APL的治疗效果差,病情凶险随着对APL的细胞生物学的特性认识的不断提高和治疗方法的改进,使治疗结果和预后有了很大的改善,早期死亡率明显下降,持续缓解时间延长是目前白血病治疗效果最好的一种类型。
|
|||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||
| 关于“急性早幼粒细胞白血病”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |