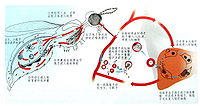
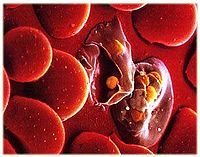
疟原虫
| A+医学百科 >> 疟原虫 |
目录 |
分类学地位及亚种
疟原虫属于真球虫目(Eucoccidiida)、疟原虫科(Plasmodidae)、疟原虫属(Plasmodium),是疟疾(malaria)的病原体。
疟原虫种类繁多,寄生于人类的疟原虫有4种,即间日疟原虫[Plasmodium vivax(Grassi and Felletti,1890) Labbe,1899]、恶性疟原虫[Plasmodium falciparum(Welch,1897) Schaudinn,1902]、三日疟原虫[Plasmodium malariae (Laveran,1881) Grassi and Felletti,1890]和卵形疟原虫[Plasmodium ovale Stephens,1922],分别引起间日疟、恶性疟、三日疟和卵形疟。在我国主要有间日疟原虫和恶性疟原虫,三日疟原虫少见,卵形疟原虫罕见。
形态
疟原虫的基本结构包括核、胞质和胞膜,环状体以后各期尚有消化分解血红蛋白后的最终产物—疟色素。血片经姬氏或瑞氏染液染色后,核呈紫红色,胞质为天蓝至深蓝色,疟色素呈棕黄色、棕褐色或黑褐色。四种人体疟原虫的基本结构相同,但发育各期的形态又各有不同,可资鉴别。除了疟原虫本身的形态特征不同之外,被寄生的红细胞在形态上也可发生变化。被寄生红细胞的形态有无变化以及变化的特点,对鉴别疟原虫种类很有帮助。
1.疟原虫在红细胞内发育各期的形态 疟原虫在红细胞内生长、发育、繁殖,形态变化很大。一般分为三个主要发育期。
(1)滋养体(trophozoite):为疟原虫在红细胞内摄食和生长、发育的阶段。按发育先后,滋养体有早、晚期之分。早期滋养体胞核小,胞质少,中间有空泡,虫体多呈环状,故又称之为环状体(ring form)。以后虫体长大,胞核亦增大,胞质增多,有时伸出伪足,胞质中开始出现疟色素(malarial pigment)。间日疟原虫和卵形疟原虫寄生的红细胞可以变大、变形,颜色变浅,常有明显的红色薛氏点(Schuffner’s dots);被恶性疟原虫寄生的红细胞有粗大的紫褐色茂氏点(Maurer’s dots);被三日疟原虫寄生的红细胞可有齐氏点(Ziemann’s dots)。此时称为晚期滋养体,亦称大滋养体。
(2)裂殖体(schizont):晚期滋养体发育成熟,核开始分裂后即称为裂殖体。核经反复分裂,最后胞质随之分裂,每一个核都被部分胞质包裹,成为裂殖子(merozoite),早期的裂殖体称为未成熟裂殖体,晚期含有一定数量的裂殖子且疟色素已经集中成团的裂殖体称为成熟裂殖体。
(3)配子体(gametocyte):疟原虫经过数次裂体增殖后,部分裂殖子侵入红细胞中发育长大,核增大而不再分裂,胞质增多而无伪足,最后发育成为圆形、卵圆形或新月形的个体,称为配子体;配子体有雌、雄(或大小)之分:雌(大)配子体虫体较大,胞质致密,疟色素多而粗大,核致密而偏于虫体一侧或居中;雄(小)配子体虫体较小,胞质稀薄,疟色素少而细小,核质疏松、较大、位于虫体中央。
2.超微结构
(1)裂殖子:红细胞
内期裂殖子呈卵圆形,有表膜复合膜(pellicular complex)包绕。大小随虫种略有不同,平均长1.5µm,平均直径1µm。
表膜(pellicle)由一质膜和两层紧贴的内膜组成。质膜厚约7.5µm,内膜厚约15µm,有膜孔。紧靠内膜的下面是一排起于顶端极环(polar ring)并向后部放散的表膜下微管(subpellicular microtubule)。内膜和表膜下微管可能起细胞骨架作用,使裂殖子有硬度。游离的裂殖子的外膜有一厚约20µm表被(surface coat)覆盖。此表被是电子致密、坚实的纤丝,在性质上似是蛋白质,可能在对宿主免疫反应的应答中起作用。在裂殖子侧面表膜有一胞口(cytostome),红细胞内期各期原虫通过胞口摄取宿主细胞浆。
裂殖子顶端是一截头的圆锥形突起称为顶突(apical prominence),有三个极环。在此区可见两个电子致密的棒状体(rhoptry)和数个微线体(micronemes)。棒状体和微线体可能在裂殖子侵入宿主细胞时起作用。裂殖子后部可见一线粒体。内质网很少,但胞浆内有丰富的核糖体。高尔基氏复合体不明显。裂殖子的核大而圆,位于虫体后半部,沿核膜可见核孔,未见有核仁。
(2)子孢子:子孢子形状细长,长约11µm,直径为1.0µm,常弯曲呈C形或S形,前端稍细,顶端较平,后端钝圆,体表光滑。子孢子内的细胞器基本上与裂殖子相似。表膜由一外膜、双层内膜和一层表膜下微管组成。膜下微管自极环向后延伸至核或稍越过核而终止。虫体的微弱运动可能是膜下微管的伸缩引起的。子孢子的前端顶部有一向内凹入的顶杯(anterior cup)即顶突,在顶突的周围有3~4个极环。细胞核一个,长形。有一对电子致密的棒状体,可能开口于顶环。在核的前方或后方,有数量很多的微线体,呈圆形、卵圆形或长形。
生活史
寄生于人体的4种疟原虫生活史基本相同,需要人和按蚊二个宿主。在人体内先后寄生于肝细胞和红细胞内,进行裂体增殖(schizogony)。在红细胞内,除进行裂体增殖外,部分裂殖子形成配子体,开始有性生殖的初期发育。在蚊体内,完成配子生殖(gametogony),继而进行孢子增殖(sporogony)。
1.在人体内的发育 分肝细胞内的发育和红细胞内的发育二个阶段:
(1)红细胞外期(exo-erythrocytic cycle,简称红外期):当唾腺中带有成熟子孢子(sporozoite)的雌性按蚊刺吸人血时,子孢子随唾液进入人体,约经30分钟后随血流侵入肝细胞,摄取肝细胞内营养进行发育并裂体增殖,形成红细胞外期裂殖体。成熟的红细胞外期裂殖体内含数以万计的裂殖子。裂殖子胀破肝细胞后释出,一部分裂殖子被巨噬细胞吞噬,其余部分侵入红细胞,开始红细胞内期的发育。间日疟原虫完成红细胞外期的时间约8天,恶性疟原虫约6天,三日疟原虫为11~12天,卵形疟原虫为9天。
目前一般认为间日疟原虫和卵形疟原虫的子孢子具有遗传学上不同的两种类型,即速发型子孢子(tachysporozoites,TS)和迟发型子孢子(bradysporozoites,BS)。当子孢子进入肝细胞后,速发型子孢子继续发育完成红细胞外期的裂体增殖,而迟发型子孢子视虫株的不同,需经过一段或长或短(数月至年余)的休眠期后,才完成红细胞外期的裂体增殖。经休眠期的子孢子被称之为休眠子(hypnozoite)。恶性疟原虫和三日疟原虫无休眠子。
(2)红细胞内期(erythrocytic cycle,简称红内期):红细胞外期的裂殖子从肝细胞释放出来,进入血流后很快侵入红细胞。裂殖子侵入红细胞的过程包括以下步骤:
①裂殖子通过特异部位识别和附着于红细胞膜表面受体;②红细胞广泛性变形,红细胞膜在环绕裂殖子处凹入形成纳虫空泡;③裂殖子入侵完成后纳虫空泡密封。在入侵过程中裂殖子的细胞表被脱落于红细胞中。
侵入的裂殖子先形成环状体,摄取营养,生长发育,经大滋养体、未成熟裂殖体,最后形成含有一定数量裂殖子的成熟裂殖体。红细胞破裂后,裂殖子释出,其中一部分被巨噬细胞吞噬,其余再侵入其他正常红细胞,重复其红细胞内期的裂体增殖过程(图11—3)。完成一代红细胞内期裂体增殖,间日疟原虫约需48小时,恶性疟原虫约需36~48小时,三日疟原虫约需72小时,卵形疟原虫约需48小时。恶性疟原虫的早期滋养体在外周血液中经十几小时的发育后,逐渐隐匿于微血管、血窦或其他血流缓慢处,继续发育成晚期滋养体及裂殖体,这2个时期在外周血液中一般不易见到。
疟原虫经几代红细胞内期裂体增殖后,部分裂殖子侵入红细胞后不再进行裂体增殖而是发育成雌、雄配子体。恶性疟原虫的配子体主要在肝、脾、骨髓等器官的血窦或微血管里发育,成熟后始出现于外周血液中,约在无性体出现后7~10天才见于外周血液中。配子体的进一步发育需在蚊胃中进行,否则在人体内经30~60天即衰老变性而被清除。
4种疟原虫寄生于红细胞的不同发育期,间日疟原虫和卵形疟原虫主要寄生于网织红细胞,三日疟原虫多寄生于较衰老的红细胞,而恶性疟原虫可寄生于各发育期的红细胞。
2.疟原虫在按蚊体内的发育 当雌性按蚊刺吸病人或带虫者血液时,在红细胞内发育的各期原虫随血液入蚊胃,仅雌、雄配子体能在蚊胃内继续发育,其余各期原虫均被消化。在蚊胃内,雄配子体核分裂成4-8块,胞质也向外伸出4-8条细丝;不久,每一小块胞核进入一条细丝中,细丝脱离母体,在蚊胃中形成雄配子(male gamete)。雄配子体在蚊胃中游动,此后,钻进雌配子(female gamete)体内,受精形成合子(zygote)。合子变长,能动,成为动合子(ookinete)。动合子穿过胃壁上皮细胞或其间隙,在蚊胃基底膜下形成圆球形的卵囊(oocyst)。卵囊长大,囊内的核和胞质反复分裂进行孢子增殖,从成孢子细胞(sporoblasy)表面芽生子孢子,形成数以万计的子孢子(sporozoite)。子孢子随卵囊破裂释出或由囊壁钻出,经血淋巴集中于按蚊的涎腺,发育为成熟子孢子。当受染蚊再吸血时,子孢子即可随唾液进入人体,又开始在人体内的发育。在最适条件下,疟原虫在按蚊体内发育成熟所需时间:间日疟原虫约为9~10天,恶性疟原虫约为10~12天,三日疟原虫约为25~28天,卵形疟原虫约为16天。
疟原虫在蚊体内发育受多种因素影响,诸如配子体的感染性(成熟程度)与活性、密度及雌雄配子体的数量比例,蚊体内生化条件与蚊体对入侵疟原虫的免疫反应性,以及外界温、湿度变化对疟原虫蚊期发育的影响。
营养代谢
疟原虫可通过表膜的渗透或经胞口以吞饮方式摄取营养。在肝细胞内寄生的红细胞外期疟原虫,以肝细胞的胞质为营养。
1.葡萄糖代谢 红细胞内期疟原虫的糖原储存很少,葡萄糖是疟原虫红细胞内期主要的能量来源。疟原虫的寄生使红细胞膜发生变化,增强了葡萄糖通过膜的主动转运,或者除去某些抑制转运的因子,从而使疟原虫可源源不断地从宿主的血浆获得葡萄糖以供代谢之用。6-磷酸葡萄糖脱氢酶(G6PD)是戊糖磷酸途径所需要的酶,受染疟原虫的红细胞内G6PD缺乏时,影响疟原虫分解葡萄糖,导致虫体发育障碍。缺乏G6PD的病人对恶性疟原虫有选择抗性是否与此有关尚待进一步研究。
2.蛋白质代谢 疟原虫获得的游离氨基酸主要是来自红细胞内的血红蛋白的水解产物,还来自宿主的血浆和红细胞内的氨基酸库及有机物碳。血红蛋白从疟原虫胞口被吞入,由胞口基部长出食物泡,胞口孔被膜封闭。血红蛋白被食物泡内的酸性肽链内切酶和氨基肽酶的协同作用消化分解为珠蛋白和血红素。珠蛋白在酶的作用下再分解为几种氨基酸以供合成虫体本身的蛋白质。血红素最后形成一种复合物即疟色素。疟色素不被溶解和吸收而留在食物泡的壁上。在红细胞内裂体增殖过程中,疟色素逐渐融合成团,随着裂体增殖完成后被排入血流。
3.核酸代谢 疟原虫没有从头合成嘌吟的途径,仅依靠一个补救途径利用现成的嘌呤碱基和核苷。参与嘌呤补救途径的酶有腺苷酸脱氢酶、嘌呤—核苷磷酸化酶等。
在疟原虫的多种生物合成途径中,对氨基苯甲酸(PABA)、四氢叶酸(THF)等都是很重要的辅助因子。如果宿主的食物中缺乏PABA,则影响THF的生成,其体内寄生的疟原虫的生长繁殖发生障碍,感染因而被抑制。
4.脂类代谢 疟原虫无脂类储存,也不能合成脂肪酸与胆固醇,完全依赖于宿主提供,如从宿主血浆中获得游离脂肪酸和胆固醇,胆固醇对维持疟原虫及受染细胞的膜的完整性都具有重要作用。红细胞内疟原虫所需的脂类可由摄入的葡萄糖代谢的产物组成,其中主要为磷脂,磷脂增多与疟原虫膜的合成有关。
致病
疟原虫的主要致病阶段是红细胞内期的裂体增殖期。致病力强弱与侵入的虫种、数量和人体免疫状态有关。
1.潜伏期(incubation period) 指疟原虫侵入人体到出现临床症状的间隔时间,包括红细胞外期原虫发育的时间和红细胞内期原虫经几代裂体增殖达到一定数量所需的时间。潜伏期的长短与进入人体的原虫种株、子孢子数量和机体的免疫力有密切关系。恶性疟的潜伏期为7~27天;三日疟的潜伏期为18~35天;卵形疟的潜伏期为11~16天;间日疟的短潜伏期株为11~25天,长潜伏期株为6~12个月或更长。对我国河南、云南、贵州、广西和湖南等省志愿者进行多次感染间日疟原虫子孢子的实验观察,表明各地均兼有间日疟长、短潜伏期2种类型,而且二者出现的比例有由北向南短潜伏期比例增高的趋势。由输血感染诱发的疟疾,潜伏期一般较短。
2.疟疾发作(paroxysm) 疟疾的一次典型发作表现为寒战、高热和出汗退热三个连续阶段。发作是由红细胞内期的裂体增殖所致,当经过几代红细胞内期裂体增殖后,血中原虫的密度达到发热阈值(threshold),如间日疟原虫为10~500个/µl血,恶性疟原虫为500~1300个/µl血。红细胞内期成熟裂殖体胀破红细胞后,大量的裂殖子、原虫代谢产物及红细胞碎片进入血流,其中一部分被巨噬细胞、中性粒细胞吞噬,刺激这些细胞产生内源性热原质,它和疟原虫的代谢产物共同作用于宿主下丘脑的体温调节中枢,引起发热。随着血内刺激物被吞噬和降解,机体通过大量出汗,体温逐渐恢复正常,机体进入发作间歇阶段。由于红细胞内期裂体增殖是发作的基础,因此发作具有周期性,此周期与红细胞内期裂体增殖周期一致。典型的间日疟和卵形疟隔日发作1次;三日疟为隔2天发作1次;恶性疟隔36~48小时发作1次。若寄生的疟原虫增殖不同步时,发作间隔则无规律,如初发患者。不同种疟原虫混合感染时或有不同批次的同种疟原虫重复感染时,发作也多不典型。疟疾发作次数主要取决于患者治疗适当与否及机体免疫力增强的速度。随着机体对疟原虫产生的免疫力逐渐增强,大量原虫被消灭,发作可自行停止。
3.疟疾的再燃和复发 疟疾初发停止后,患者若无再感染,仅由于体内残存的少量红细胞内期疟原虫在一定条件下重新大量繁殖又引起的疟疾发作,称为疟疾的再燃(recrudescence)。再燃与宿主抵抗力和特异性免疫力的下降及疟原虫的抗原变异有关。疟疾复发(relapse)是指疟疾初发患者红细胞内期疟原虫已被消灭,未经蚊媒传播感染,经过数周至年余,又出现疟疾发作,称复发。关于复发机理目前仍未阐明清楚,其中子孢子休眠学说认为由于肝细胞内的休眠子复苏,发育释放的裂殖子进入红细胞繁殖引起的疟疾发作。恶性疟原虫和三日疟原虫无迟发型子孢子,因而只有再燃而无复发。间日疟原虫和卵形疟原虫既有再燃,又有复发。
4. 贫血(anemia) 疟疾发作数次后,可出现贫血,尤以恶性疟为甚。怀孕妇
女和儿童最常见,流行区的高死亡率与严重贫血有关。贫血的原因除了疟原虫直接破坏红细胞外,还与下列因素有关:①脾功能亢进,吞噬大量正常的红细胞。②免疫病理的损害。疟原虫寄生于红细胞时,使红细胞隐蔽的抗原暴露,刺激机体产生自身抗体,导致红细胞的破坏。此外宿主产生特异抗体后,容易形成抗原抗体复合物,附着在红细胞上的免疫复合物可与补体结合,使红细胞膜发生显著变化而具有自身免疫原性,并引起红细胞溶解或被巨噬细胞吞噬。疟疾患者的贫血程度常超过疟原虫直接破坏红细胞的程度。③骨髓造血功能受到抑制。
5.脾肿大 初发患者多在发作3~4天后,脾开始肿大,长期不愈或反复感染者,脾肿大十分明显,可达脐下。主要原因是脾充血和单核—巨噬细胞增生。早期经积极抗疟治疗,脾可恢复正常大小。慢性患者,由于脾包膜增厚,组织高度纤维化,质地变硬,虽经抗疟根治,也不能恢复到正常。
在非洲或亚洲某些热带疟疾流行区,出现“热带巨脾综合症”,可能是有疟疾的免疫反应所引起。患者多伴有肝大、门脉高压、脾功能亢进、巨脾症、贫血等症状;血中IgM水平增高。
6.凶险型疟疾 凶险型疟疾绝大多数由恶性疟原虫所致,但间日疟原虫引起的脑型疟国内已有报道。多数学者认为,凶险型疟疾的致病机制是聚集在脑血管内被疟原虫寄生的红细胞和血管内皮细胞发生粘连,造成微血管阻塞及局部缺氧所致。此型疟疾多发生于流行区儿童、无免疫力的旅游者和流动人口。
临床表现复杂,常见的有脑型和超高热型,多表现为持续高烧、全身衰竭、意识障碍、呼吸窘迫、多发性惊厥、昏迷、肺水肿、异常出血、黄疸、肾功能衰竭、血红蛋白尿和恶性贫血等。凶险型疟疾来势凶猛,若不能及时治疗,死亡率很高。
脑型疟疾(cerebral malaria, CM)大多数发生于恶性疟患者,但国内已报道由间日疟引起的,是儿童和无免疫力成人患者的主要死亡原因,临床上中枢神经系统症状明显,如剧烈头痛、昏迷、谵妄、抽搐、惊厥、体温高达40~41oC、但个别也有不发热者。常因昏迷并发感染而死亡。CM的发病机制、学说不一,近年报道是一种多因素参与的免疫病理性疾病。患者体内某些细胞因子、粘附因子和一氧化碳是引起CM发病的重要因素,如过量的TNF-α、IFN-γ等细胞因子激活内皮细胞表达粘附受体,增强内皮细胞的粘附性,使受染红细胞粘附与脑的微血管内,导致血管阻塞,制成脑局部缺氧和营养耗竭而引起脑并发症。
在不同疟疾流行区,凶险型疟疾的高发人群和临床表现都很不同。在稳定的高度疟疾流行区,出生几个月的婴儿和5岁以下的幼童是凶险型疟疾的高发人群,主要的临床表现是恶性贫血。在中度疟疾流行区,脑型疟疾和代谢性酸中毒是儿童常见的凶险型疟疾。在低度疟疾流行区,急性肾衰竭、黄疸和肺水肿是成年人常见的临床表现,贫血、低血糖症和惊厥在儿童中比较多见,而脑型疟疾和代谢性酸中毒在所有的年龄组都可有。
免疫
1.先天抵抗力(natural resistance) 这种抵抗力与宿主的疟疾感染史无关,而与宿主的种类和遗传特性有关。如90%以上的西非黑人为Duffy抗原阴性血型, 而间日疟原虫裂殖子在红细胞膜上的受体是Duffy血型抗原,裂殖子入侵红细胞需要Duffy血型物质作为受体,Duffy血型阴性者红细胞膜上无此受体,因而间日疟原虫不能入侵红细胞。由遗传因素造成的镰状细胞贫血者,对恶性疟原虫不易感。在非洲患镰状细胞贫血的儿童其恶性疟的感染率低于正常儿童,且前者的重症疟疾及因疟疾而死亡的比例远少于后者。这是因为在缺氧条件下红细胞内钾离子浓度下降,可造成疟原虫死亡;由于镰状细胞血红蛋白较难溶于水,使疟原虫的吞噬和胞饮作用发生障碍;在氧分压较低时血红蛋白可形成微结晶并刺入疟原虫的表膜,从而影响其生存。葡萄糖—6-磷酸脱氢酶(G6PD) 缺乏者对疟原虫也具有先天抵抗力,临床研究证实,G6PD 缺乏的儿童可以免遭重症恶性疟疾。缺乏者的红细胞对氧化剂特别敏感,而疟原虫的发育需利用宿主细胞内的还原型辅酶II,因此受感染的红细胞在疟原虫成熟前就有自然溶解的倾向。研究先天抵抗力的遗传因素有助于抗疟疫苗及抗疟药物的开发。相反,地中海贫血者由于其红细胞内ATP水平较低,有利于疟原虫的发育,因此此类患者对疟原虫的抵抗力较差,罹患疟疾时病死率较高。
2.获得性免疫 人体在感染疟疾后诱导产生有效的免疫。此种免疫为种特异性,对异种疟原虫的攻击基本上无保护作用,此外,还有株和期的特异性,人体对疟原虫某一发育期产生的抗性对其他发育期不一定具有抵抗力。
(1)疟原虫抗原:疟原虫抗原来源于虫体表面或内部,包括裂殖子形成过程中疟原虫残留的胞浆、含色素的膜结合颗粒、死亡或变形的裂殖子、疟原虫空泡内容物及其膜、裂殖子分泌物及疟原虫侵入红细胞时被修饰或脱落的表被物质。种内和种间各期疟原虫可能有共同抗原,而另外一些抗原则具有种、期特异性。这些具有种、期特异性的抗原在产生保护性抗体方面可能有重要作用。
来自宿主细胞的抗原不仅包括被疟原虫破坏的肝细胞和红细胞,也包括局部缺血或辅助免疫机制的激活(如补体系统)所破坏的许多其他组织细胞。
(2)体液免疫:体液免疫在疟疾保护性免疫中有十分重要的作用。当原虫血症出现后,血清中IgG、IgM和IgA的水平明显增高,尤以前两者更甚。但这些Ig中具有对疟原虫特异性的抗体只是一小部分。通过单克隆抗体及免疫血清对体外培养的疟原虫生长的抑制以及在机体内作被动转移免疫力的实验,都可以证明体液免疫对疟原虫的重要作用。
抗体可通过下列几种方式阻止裂殖子侵入红细胞:补体介导损害裂殖子;空间上干扰对红细胞配体的识别以影响侵入过程;阻止表面蛋白成熟;裂殖体破裂时,通过凝集裂殖子阻止其释放。
(3)细胞介导免疫:疟疾感染过程中,细胞介导免疫具有重要的作用。细胞介导免疫主要包括单核吞噬细胞、T细胞和自然杀伤细胞,以及由这些细胞分泌的细胞因子,如IFN-γ、TNF等。
总之,抗疟疾的免疫机制十分复杂,非特异性与特异性免疫互为条件、相互补充,体液与细胞免疫相互调节、相互平衡,疟原虫抗原与宿主的MHC之间的相互关系等都可能对机体的免疫过程及其后果产生影响,很多问题还有待深入研究。
(4)带虫免疫及免疫逃避:人类感染疟原虫后产生的免疫力,能抵抗同种疟原虫的再感染,但同时其血液内又有低水平的原虫血症,这种免疫状态称为带虫免疫(premunition)。通过被动输入感染者的血清或已致敏的淋巴细胞给易感宿主,可使之对疟原虫的感染产生抵抗力,这说明机体有特异性抑制疟原虫在红细胞内的发育的免疫效应。
宿主虽有产生各种体液免疫和细胞免疫应答的能力,以抑制疟原虫的发育增殖,但疟原虫也有强大的适应能力来对抗宿主的免疫杀伤作用。疟原虫逃避宿主免疫攻击的机制十分复杂,与之有关的主要因素包括下列几个方面:
1)寄生部位:不论红细胞外期或红细胞内期的疟原虫,主要在宿主细胞内生长发育以逃避宿主的免疫攻击。
2)抗原变异(antigenic variation)和抗原多态性(polymorphism):即与前身抗原性稍有改变的变异体。诺氏疟原虫在慢性感染的猴体内每次再燃都有抗原变异。大量证据说明在同一疟原虫虫种内存在着许多抗原性有差异的株。
有效的免疫反应常受到高度多态性抗原的制约。几种疟原虫蛋白质序列多态性很常见,特别是有广泛重复区的蛋白,例如环子孢子蛋白(CSP),该抗原能下调抗体成熟和高亲和力抗体产生;恶性疟裂殖子表面蛋白-1(MSP-1)可以诱导MSP-1的“阻断抗体”,这种抗体可以阻止任何有抑制能力抗体的连接。
3)改变宿主的免疫应答性:患急性疟疾时,机体的免疫应答性和淋巴细胞亚群在外周血液、脾和淋巴结中的分布都有明显改变。一般均有T细胞的绝对值减少,B细胞相对值增加,与此同时,表现有免疫抑制、多克隆淋巴细胞活化,毒杀淋巴细胞抗体(lymphocytotoxic antibody)及可溶性循环抗原等。
(5)疟疾疫苗:疟疾疫苗的研究在最近的30年中仍取得了明显的成果。已研制出了一系列针对疟原虫生活史各期的候选疫苗。疟疾疫苗可分为子孢子疫苗(抗感染疫苗)、肝期疫苗(抗红细胞外期疫苗)、无性血液期疫苗(抗红细胞内期疫苗和抗裂殖子疫苗)和有性期疫苗(传播阻断疫苗)等。
由于疟原虫抗原虫期多且抗原成分复杂,因此单一抗原成分的疫苗免疫效果较差。多虫期多抗原复合疫苗是目前研究的重点,其中有些已取得令人鼓舞的结果,如利用疟原虫CS段重复序列的B细胞表位和非重复区的辅助T细胞表位组成的多抗原系统(MASP)免疫动物后能产生较高的保护性免疫力,但离实际应用还有一段距离。
二.媒介按蚊对疟原虫的免疫 按蚊(Anopheles)是疟疾的传播媒介,不但为疟原虫在蚊体内的配子生殖和孢子生殖提供了必要的内环境和相关因子,而且按蚊的免疫系统也对疟原虫的发育和繁殖发挥抑制作用。蚊吸血时,通常有大量的配子体随血餐进入蚊胃,但是蚊胃内的疟原虫受按蚊的免疫攻击,只有约1/10~1/20的能发育成动合子,当动合子穿过蚊胃上皮细胞后,只有极少数卵囊成熟,孢子生殖产生大量的子孢子释放到蚊血淋巴中,但能在唾液腺内发育成感染性子孢子的也只有很少一部分。由此可见,按蚊的免疫系统能抑制疟原虫的发育。按蚊对疟原虫的杀灭作用主要是通过黑化包被反应进行的,此外,受染按蚊产生的NO和抗菌肽也对疟原虫在蚊体内的发育具有一定的抑制作用。
黑化包被反应是一种体液性黑化反应 (humoral melanization)。与其它昆虫一样,按蚊的黑化反应是由前酚氧化酶级联反应 (prophenoloxidase cascade)介导引起的。通过激活前酚氧化酶活化酶,使前酚氧化酶转变成有活性的酚氧化酶(phenoloxidase,PO),然后,PO羟化单酚氧化酶并氧化双酚氧化酶,产生大量的醌类中间产物聚合形成黑色素。这些黑色素协同具有细胞毒性的醌类中间产物沉积到入侵的病原体周围,起到隔离杀死病原体的作用,即黑化包被反应。
实验诊断
1.病原学诊断 厚、薄血膜染色镜检是目前最常用的方法。从受检者外周血液中检出疟原虫是确诊的最可靠依据,最好在服药以前取血检查。取外周血制作厚、薄血膜,经姬氏或瑞氏染液染色后镜检查找疟原虫。薄血膜中疟原虫形态完整、典型,容易识别和鉴别虫种,但原虫密度低时,容易漏检。厚血膜由于原虫比较集中,易检获,但染色过程中红细胞溶解,原虫形态有所改变,虫种鉴别较困难。因此,最好一张玻片上同时制作厚、薄两种血膜,如果在厚血膜查到原虫而鉴别有困难时,可再检查薄血膜。恶性疟在发作开始时,间日疟在发作后数小时至10余小时采血能提高检出率。
2.免疫学诊断
(1)循环抗体检测:常用的方法有间接荧光抗体试验、间接血凝试验和酶联免疫吸附试验等。由于抗体在患者治愈后仍能持续一段时间,且广泛存在着个体差异,因此检测抗体主要用于疟疾的流行病学调查、防治效果评估及输血对象的筛选,而在临床上仅作辅助诊断用。
(2)循环抗原检测:利用血清学方法检测疟原虫的循环抗原能更好地说明受检对象是否有活动感染。常用的方法有放射免疫试验、抑制法酶联免疫吸附试验、夹心法酶联免疫吸附试验和快速免疫色谱测试卡 (ICT)等。
3.分子生物学技术 PCR和核酸探针已用于疟疾的诊断,分子生物学检测技术的最突出的优点是对低原虫血症检出率较高。用核酸探针检测恶性疟原虫,其敏感性可达感染红细胞内0.0001%的原虫密度。国内学者采用套式 PCR技术扩增间日疟原虫 SSU rRNA基因120bp的特定片段,其敏感性达0.1原虫/μl血。
流行病学
1.流行概况 疟疾是严重危害人类健康的疾病之一,据世界卫生组织(WHO)统计,目前世界上仍有90多个国家为疟疾流行区,全球每年发病人数达3亿~5亿,年死亡人数达100万~200万,其中80 %以上的病例发生在非洲。
建国前,我国疟疾流行严重,流行地区可分为四类:
(1)高疟区:在北纬25°以南,即南岭山脉以南地区,是我国疟疾流行最严重的地区。除间日疟、恶性疟和三日疟外,卵形疟也偶有报道。恶性疟和混合感染比例均高。
(1) 稳定中疟区和低疟区:在北纬25~33°之间,即南岭山脉和秦岭、淮
河之间地区。以间日疟为主,兼有恶性疟,常有暴发流行。
(2) 非稳定低疟区:北纬33°以北,即秦岭、淮河以北地区,疟疾流行相
对较轻,间日疟原虫为唯一虫种,但亦有因恶性疟输入而引起的流行。
(4)天然无疟区:包括青藏高原、西北、内蒙的荒漠和东北林区。新疆伊犁河流域和南疆少部分地区仅有少数间日疟发生。
据不完全统计,20世纪40年代我国每年至少有3000万以上疟疾患者,病死率约为1%。50年代初期,全国有疟疾流行的县(市)计1,829个,占当时县(市)总数的70%~80%。
随着抗疟工作进展,恶性疟流行范围逐渐缩小,1995年后除海南、云南两省仍有恶性疟流行外,其余各省、自治区、直辖市已无恶性疟传播。疟疾病死率已由1950年的0.49%下降至1998年的0.08%。 1996~1998年全国疟疾发病降至3万余例,但2000年疫情出现回升,发病人数为26.6万,尤其在我国中部地区的苏、豫、皖、鄂等省曾出现过局部暴发流行。
人群带虫率是反映疟疾流行程度的一个重要指标。50年代南部和西南部各省、自治区居民带虫率一般在10%~20%,高的达50%以上,中部地区人群带虫率一般为5%~10%。经过多年大规模抗疟,人群带虫率逐年降低。1991~1998年对监测点居民、学生、流动人口等重点人群共血检484.8万人次,除了海南、云南两省人群带虫率尚在1%~3%外,其余各省、自治区、直辖市均在1%以下。
2.流行环节
(1)传染源:外周血中有配子体的患者和带虫者是疟疾的传染源。间日疟原虫的配子体常在原虫血症2~3天后出现,恶性疟原虫配子体在外周血中出现较晚,要在原虫血症后7~11天才出现,血中带红细胞内期疟原虫的献血者也可通过供血传播疟疾。
(2)传疟媒介:按蚊是疟疾的传播媒介,我国主要的传疟按蚊是中华按蚊、嗜人按蚊、微小按蚊和大劣按蚊。
(3)易感人群:除了因某些遗传因素对某种疟原虫表现出不易感的人群及高疟区婴儿可从母体获得一定的抵抗力外,其他人群对人疟原虫普遍易感。反复多次的疟疾感染可使机体产生一定的保护性免疫力,因此疟区成人发病率低于儿童,而外来的无免疫力的人群,常可引起疟疾暴发。
疟疾的流行除需具备上述三个基本环节外,传播强度还受自然因素和社会因素的影响。自然因素中温度和雨量最为重要,适合的温度和雨量影响着按蚊的数量和吸血活动及原虫在按蚊体内的发育。全球气候变暖,延长了虫媒的传播季节是疫情回升的原因之一。社会因素如政治、经济、文化、卫生水平及人类的社会活动等直接或间接地影响疟疾的传播与流行。近年来,我国有些地区疫情上升,其主要原因是经济开发后流动人口增加,输入病例增多,引起传染源扩散。
防治
1946年DDT杀灭成蚊的试验取得成效后,使得消灭疟疾成为可能,1955年第8届世界卫生大会把以前的控制疟疾策略改为消灭疟疾策略,随着时间的推移,人们发现利用杀虫剂消灭媒介按蚊面临着越来越多的问题,诸如耐药蚊种的出现,杀虫剂造成的环境污染以及生态平衡等问题,终使全球灭疟规划受到严重挫折。1978年第31次世界卫生大会决定放弃全球限期灭疟的规划,把对疟疾的防治对策改回到控制的策略。20年间经历的这两次策略大转变,不仅反映了疟疾问题的复杂性,同时亦体现人们对疟疾作斗争的认识在不断提高。
我国目前的疟疾防治策略是执行“因地制宜、分类指导、突出重点”的方针,采取相对应的综合性防治措施,坚持长期作战,反复斗争。在以中华按蚊为唯一媒介的广大地区,采取以防治传染源和防蚊为重点,结合减少村内外蚊虫孳生地的综合措施。在微小按蚊、嗜人按蚊为主要媒介的地区,采取灭蚊和防治传染源并重的措施。在大劣按蚊为主要媒介的地区,采取以改变生态环境、防制传播媒介为主、结合传染源防治的综合措施。在发病率已降至1/万以下的基本消灭疟疾的地区,采取以疟疾监测为主的措施。
1.预防 包括个体预防和群体预防。预防措施有蚊媒防制和预防服药。蚊媒防制包括杀灭蚊和使用蚊帐及驱蚊剂。预防服药是保护易感人群的重要措施之一。常用的预防性抗疟药有氯喹(chloroquine),对抗氯喹的恶性疟,可用哌喹(piperaquine)或哌喹加乙胺嘧啶(pyrimethamine)或乙胺嘧啶加伯氨喹啉(primaquine)。不论个体或群体进行预防服药,每种药物疗法不宜超过半年。
2.治疗:疟疾治疗应包括对现症病人的治疗(杀灭红细胞内期疟原虫)和疟疾发作休止期的治疗(杀灭红细胞外期休眠子)。休止期的治疗是指在疟疾传播休止期,对1~2年内有疟疾史和带虫者的治疗,以控制间日疟的复发和减少传染源。
按抗疟药对疟原虫不同虫期的作用,可将其分为杀灭红细胞外期裂子体及休眠子的抗复发药,如伯氨喹啉;杀灭红细胞内裂体增殖期的抗临床发作药,如氯喹、咯萘啶(pyronaridine)、青蒿素(artmisinin)类和杀灭子孢子抑制蚊体内孢子增殖的药,如乙胺嘧啶。
对现症患者,可用氯喹加伯氨喹啉,以治疗疟疾疑似患者或间日疟;抗间日疟复发(休止期治疗)可用伯氨喹啉加乙胺嘧啶、青蒿琥酯加伯氨喹啉效果更佳;恶性疟可单服氯喹,抗氯喹的恶性疟则宜联合用药,如哌喹加磺胺多辛(sulfadoxine)、咯萘啶加磺胺多辛及伯氨喹啉、复方蒿甲醚片等,单用青蒿琥酯、蒿甲醚、双氢青蒿素等也有一定疗效;重症疟疾(如脑型疟)首选青蒿素类药物,如蒿甲醚油剂肌注、青蒿琥酯钠静注、或静注双氢青蒿素加二盐酸喹啉;此外,青蒿素类药物的栓剂适用于不能口服药物的患者。上述各种抗疟药物必须足量并服完全程才能达根治疟疾的目的。
参看
| 关于“疟原虫”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |