微管
| A+医学百科 >> 微管 |
目录 |
分子结构
微管(microtubule)
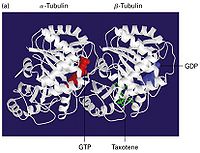
微管是一种具有极性的细胞骨架。微管是由α,β两种类型的微管蛋白亚基形成的微管蛋白二聚体,由微管蛋白二聚体组成的长管状细胞器结构。微管由微管蛋白异源二聚体为基本构件, 螺旋盘绕形成微管的壁。在每根微管中微管蛋白二聚体头尾相接, 形成细长的原纤维(protofilament), 13条这样的原纤维纵向排列组成微管的壁。微管是直径为24-26nm的中空圆柱体。外径平均为24nm, 内径为15nm。微管壁大约厚5nm,微管通常是直的, 但有时也呈弧形。细胞内微管呈网状和束状分布, 并能与其他蛋白共同组装,可装配成单管,二联管(纤毛和鞭毛中),三联管(中心粒和基体中),纺锤体、基粒、轴突、神经管等结构。它是由13 条原纤维(protofilament)构成的中空管状结构,直径22—25纳米。微管蛋白二聚体由结构相似的α和β-微管蛋白构成,两种亚基均可结合GTP,α-微管蛋白结合的GTP从不发生水解或交换,是α-微管蛋白的固有组成部分;而作为GTP酶,β-微管蛋白可水解结合的GTP,结合的GDP可交换为GTP。微管和微丝一样,具有生长速度较快解离速度较慢的(+)端和生长速度较慢解离速度较快的(-)端。微管在细胞内起支撑作用。另外它还是两种运载分子,驱动蛋白(Kinesin)和运动蛋白(Dynein)的行走轨道。微管可能连带附在其上的运动蛋白会发放信号促进粘着斑的解聚,后者是粘着斑的周转和尾部与底质分离过程中重要的一步。
微管的功能:维持细胞形态,辅助细胞内运输,与其他蛋白共同装配成纺锤体,基粒,中心粒,鞭毛,纤毛神经管等结构。
微管可在所有哺乳类动物细胞中存在,除了红细胞外,所有微管均由约55ku的α及β微管蛋白(tubulin)组成。它们正常时以αβ二聚体形式存在(110ku)并以头尾相连的方式聚合,形成微管蛋白原纤维(protofilament),由13根这样的原纤维构成一个中空的微管。
微管结合蛋白
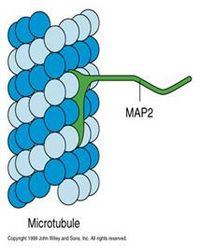
微管结合蛋白(microtubule associated proteins MAPs)分子至少包含一个结合微管的结构域和一个向外突出的结构域。突出部位伸到微管外与其它细胞组分(如微管束、中间纤维、质膜)结合(图9-17)。
MAP的主要功能是:①促进微管聚集成束;②增加微管稳定性或强度;③促进微管组装。包括I 型和II型两大类, I 型对热敏感,如MAP1a、 MAP1b,主要存在于神经细胞 。II型热稳定性高,包括 MAP2a、b、c,MAP4和tau蛋白。其中 MAP2只存在于神经细胞,,MAP2a的含量减少影响树突的生长。
微管组织
微管组织中心(microtubule organizing center MTOCs)是微管进行组装的区域,着丝粒、成膜体、中心体、基体均具有微管组织中心的功能。所有微管组织中心都具有γ微管球蛋白,这种球蛋白的含量很低,可聚合成环
状复合体,像模板一样参与微管蛋白的核化,帮助α和β球蛋白聚合为微管纤维。
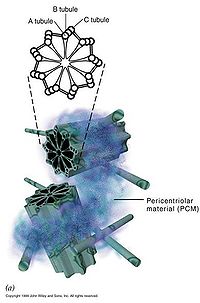
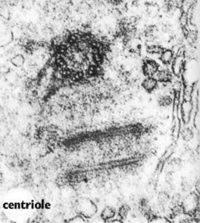
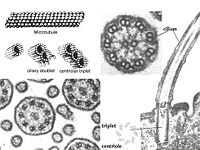
中心体(centrosome)位于细胞的中心部位(图9-18)。由两个相互垂直的中心粒(centriole)构成(图9-19),周围是一些无定形或纤维形、高电子密度的物质,叫做外中心粒物质(PCM,pericentriolar material)。中心粒直径0.2mm,长0.4mm,由9组3联微管构成,不直接参与微管蛋白的核化,具有召集PCM的作用。
微管蛋白以环状的γ球蛋白复合体为模板核化、先组装出(-)极,然后开始生长,因此中心体周围的微管(-)极指向中心体,(+)级远离中心体。
1972年R. Weisenberg证明提纯的微管,在微酸性环境(PH=6.9),适宜的温度下,存在GTP
、Mg和去除Ca的条件下能自发的组装成微管。但这种微管只有11条原纤维,可能是因为没有γ微管球蛋白构成的模板。
微管β球蛋白结合的GTP水解并不是微管组装所必需的步骤,但是结合GTP的微管蛋白二聚体能加合到微管纤维上,在快速生长的纤维两端微管球蛋白结合的GTP来不及水解,形成的“帽子”,使微管纤维较为稳定。一旦暴露出结合GDP的亚单位微管,则开始去组装。
微管的功能
1、支架作用
细胞中的微管就像混凝土中的钢筋一样,起支撑作用,在培养的细胞中,微管呈放射状排列在核外,(+)端指向质膜(图9-20),形成平贴在培养皿上的形状。在神经细胞的轴突和树突中,微管束沿长轴排列,起支撑作用,在胚胎发育阶段为管帮助轴突生长,突入
周围组织,在成熟的轴突中,微管是物质运输的路轨。
2、细胞内运输
微管起细胞内物质运输的路轨作用,破坏微管会抑制细胞内的物质运输。
与微管结合而起运输作用的马达蛋白有两大类:驱动蛋白kinesin,动力蛋白dynein,两者均需ATP提供能量。
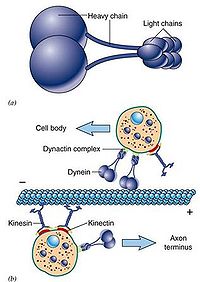
Kinesin发现于1985年,是由两条轻链和两条重链构成的四聚体(图9-21),外观具有两个球形的头(具有ATP酶活性)、一个螺旋状的杆和两个扇子状的尾。通过结合和水解ATP,导致颈部发生构象改变,使两个头部交替与微管结合,从而沿微管“行走”,将“尾部”结合的“货物”(运输泡或细胞器)转运到其它地方。据估计哺乳动物中类似于kinesin的蛋白(KLP, kinesin-like protein or KRB, kinesin-related protein)超过50余种,大多数KLP能向着微管(+)极运输小泡,也有些如Ncd蛋白(一种着丝点相关的蛋白)趋向微管的(-)极。
Dynein发现于1963年,因与鞭毛和纤毛的运动有关而得名。dynein分子量巨大(接近1.5Md),由两条相同的重链和一些种类繁多的轻链以及结合蛋白构成(鞭毛二联微管外臂的动力蛋白具有三个重链)。其作用主要有以下几个方面:在细胞分裂中推动染色体的分离、驱动鞭毛的运动、向着微管(-)极运输小泡(图9-22)。
3、形成纺锤体
纺锤体是一种微管构成的动态结构,其作用是在分裂细胞中牵引染色体到达分裂极。
4、纤毛与鞭毛的运动
纤毛与鞭毛是相似的两种细胞外长物,前者较短,约5~10um;后者较长,约150um,两者直径相似,均为0.15~0.3um。
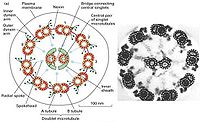
鞭毛和纤毛均由基体和鞭杆两部分构成(图9-23),鞭毛中的微管为9+2结构,即由9个联微管和一对中央微管构成,其中二联微管由AB两个管组成,A管由13条原纤维组成,B管由10条原
纤维组成,两者共用3条。A管对着相邻的B管伸出两条动力蛋白臂(图9-24),并向鞭毛中央发出一条辐。基体的微管组成为9+0,并且二联微管为三联微管所取代,结构类似于中心粒。
纤毛和鞭毛的运动是依靠动力蛋白(dynein)水解ATP,使相邻的二联
活力造成的。这种病人同时还患有慢性支气管炎,主要是因为是鞭毛和纤毛没有动力蛋白臂,不能排出侵入肺部的粒子。
|
|||||||||||||||||||||||||||||||||||||||||||||||
| 关于“微管”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |