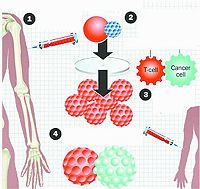
放射治疗
| A+医学百科 >> 放射治疗 |
肿瘤放射治疗是利用放射线如放射性同位素产生的α、β、γ射线和各类x射线治疗机或加速器产生的x射线、电子线、质子束及其它粒子束等治疗恶性肿瘤的一种方法。
肿瘤放射治疗(简称放疗)就是用放射线治疗癌症。放射治疗已经历了一个世纪的发展历史.在伦琴发现X线、居里夫人发现镭之后,很快就分别用于临床治疗恶性肿瘤,直到目前放射治疗仍是恶性肿瘤重要的局部治疗方法。大约70%的癌症病人在治疗癌症的过程中需要用放射治疗,约有40%的癌症可以用放疗根治。放射治疗在肿瘤治疗中的作用和地位日益突出。放射治疗已成为治疗恶性肿瘤的主要手段之一。
放射疗法仅有几十年的历史,但发展较快。由于超高压治疗机的使用,辅助工具的改进和经验的积累,治疗效果得到显著提高,目前已成为癌症治疗中的最重要手段之一。我国约有70%以上的癌症需用放射治疗,美国统计也有50%以上的癌症需用放射治疗。放射治疗几乎可用于所有的癌症治疗,对许多癌症病人而言,放射治疗是唯一必须用的治疗方法。
成千上万的人单用放射治疗或并用放射治疗、手术治疗、化学治疗和生物治疗后,治愈了他们的癌症。医生在病人手术前,可以用放射治疗来皱缩肿瘤,使之易于切除;手术后,用放射治疗来抑制残存癌细胞的生长。
目录 |
肿瘤与癌症
肿瘤分两种,有良性和恶性之分,良性的叫肿瘤,恶性的就叫做癌。
简单的说良性的称为肿瘤,一旦发展到恶性的就称为癌。
肿瘤一词在医学专著中的定义为:“肿瘤是人体器官组织的细胞,在外来和内在有害因素的长期作用下所产生的一种以细胞过度增殖为主要特点的新生物。这种新生物与受累器官的生理需要无关,不按正常器官的规律生长,丧失正常细胞的功能,破坏了原来器官结构,有的可以转移到其它部位,危及生命。”肿瘤可以分为良性肿瘤和恶性肿瘤两大类,而癌症则是一类恶性肿瘤。由于良性肿瘤对人体健康影响较小,所以下面着重介绍恶性肿瘤,特别是癌症。
恶性肿瘤从组织学上可以分为两类:一类由上皮细胞发生恶变的称为癌,如肺上皮细胞发生恶变就形成肺癌,胃上皮细胞发生恶变就形成胃癌等等;另一类由间叶组织发生恶变的称为肉瘤,如平滑肌肉瘤,纤维肉瘤等。人们对癌听得较多,而对肉瘤听得较少,这与癌病人远比肉瘤病人为多有关。临床上,癌与肉瘤之比大约为9:1。
癌作为一类恶性肿瘤,是由人体内正常细胞演变而来的。正常细胞变为癌细胞后,就像一匹脱缰的野马,人体无法约束它,产生所谓的“异常增生”。异常增生是相对于细胞的正常增生而言的。人体细胞有一个生长、繁殖衰老、死亡的过程。老化的细胞死亡后就会有新生的细胞取代它,以维持机体组织和器官的正常功能。可见,人体绝大部分细胞都可以生。但是这种正常细胞的增生是有限度的,而癌细胞的增生则是无止境的。正是由于这种恶性增生,使人体大量营养物质被消耗。同时,癌细胞还能释放出多种毒素,使人体产生一系列症状。如果发现和治疗不及时,癌细胞还可转移到全身各处生长繁殖,最后导致人体消瘦、无力、贫血、食欲不振、发热及脏器功能受损等,其后果极为严重。
五年生存率
医学界为了统计癌症病人的存活率,比较各种治疗方法的优缺点,采用大部分患者预后比较明确的情况作为统计指标,这就是医生常说的五年生存率。
五年生存率系指某种肿瘤经过各种综合治疗后,生存五年以上的比例。用五年生存率表达有其一定的科学性。某种肿瘤经过治疗后,有一部分可能出现转移和复发,其中的一部分人可能因肿瘤进入晚期而去世。转移和复发大多生在根治术后三年内,约占80%,少部分发生在根治术后五年内,约占10%。所以,各种肿瘤根治术后五年内不复发,再次复发的机会就很少了,故常用五年生存率表示各种癌症的疗效。术后五年内,一定要巩固治疗,定期检查,防止复发,即使有转移和复发也能及早治疗。另外,也有用三年生存率和十年生存率表示疗效的。
放射治疗的放射源
放射治疗的放射源主要有放射治疗机和放射性核素。
1、X线治疗机
可分为X线治疗机(10KV~60KV)、浅层治疗机X线(60KV~160KV)和深部X线治疗机(180KV~400KV)等不同能量射线。X线治疗机的缺点是能量低,穿透力弱,皮肤受量大,现已较少使用。
2、医用加速器
有电子感应加速器和电子直线加速器。前者输出高能电子束,后者输出高能电子束(8~14MeV,主要针对浅表层肿瘤)和高能X线(4~10MV,穿透力强,皮肤受量少)。医用加速器中用得最多技术发展最快的是电子直线加速器。
3、放射性核素
226镭为天然放射源,因其半衰期长,现已为人工放射性核素60 钴、137铯、192铱所替代。放射性核素可放射a、ß、r三种射线,临床上ß射线仅用于治疗表浅肿瘤,r射线为放射治疗的主要放射源,能量1.25MeV。
用60钴制成的放射治疗机,因r射线穿透力强、深部剂量高,皮肤受量少,适用于深部肿瘤的治疗。
放射治疗的种类
放射治疗主要有两种形式:体外和体内。某些病人接受两种形式的放射治疗。
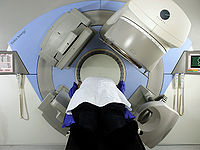
1、体外照射
体外照射又称为远距离放射治疗。这种照射技术是治疗时,放疗机将高能射线或粒子来瞄准癌肿。用于体外照射的放射治疗设备有X线治疗机、Co60治疗机和直线加速器等。60钴治疗机和直线加速器一般距人体80~100cm进行照射。单纯从身体外部进行放射治疗有一定的局限性,即使在足量照射的情况下,总有一部分肿瘤局部复发。
2、体内照射
体内照射又称为近距离放射治疗。这种治疗技术把高强度的微形放射源送入人体腔内或配合手术插入肿瘤组织内,进行近距离照射,从而有效地杀伤肿瘤组织。治疗技术涉及腔管、组织间和术中、敷贴等多种施治方式。这一技术发展很快,它可使大量无法手术治疗、外照射又难以控制或复发的病人获得再次治疗的机会,并有肯定的疗效。而正常组织不受到过量照射,以避免严重并发症,成为放射治疗技术上的一个焦点。过去,后装技术仅能用于妇科肿瘤治疗,最新一代后装治疗机已把这种技术扩大应用到鼻咽、食管、支气管、直肠、膀胱、乳腺、胰腺、脑等肿瘤。这种新技术与其他治疗方法配合,逐步形成了很有发展前途的综合治疗手段,在应用中均取得了明显的效果。
放射性粒子植入治疗肿瘤,是指在B超或CT引导下,可精确地将放射性粒子均匀地置入肿瘤周围,通过放射性粒子持续释放射线来达到最大限度地杀伤肿瘤细胞的作用。
肿瘤放射性粒子置入治疗由三个部分组成:
①放射性粒子,如198Au、125I和103pd。
②三维治疗计划系统,保证粒子置人后在空间分布上与肿瘤形状、大小一致。
放射性粒子可通过术中置入,也可通过B超或CT引导下穿刺置入。放射性粒子置入具有创伤小、肿瘤靶区剂量分布均匀和对周围正常组织损伤小、价格低廉、操作简便等特点,临床上有广阔的应用前景,将造福于肿瘤病人。美国Cooper大学医学中心放射治疗学院用大分子白蛋白(MAA)作为"生物胶",可使注入瘤体内32p安全地潴留在肿瘤内。此方法操作很简单,在CT指导下医生用带有1cm塑料护手板的活检穿刺针插入肿瘤中心,然后用两套注射器,先注人生物胶MAA,再注入32P,借助于压力使注入物从肿瘤中心向边缘扩散。此技术用于失去手术机会的胰腺癌、大肠癌肝内转移和晚期头颈部恶性肿瘤,可使肿瘤"融化消失"达数月之久。
放射治疗的作用
所有细胞(癌细胞和正常细胞)都要生长和分裂。但是癌细胞的生长和分裂比他们周围许多的正常细胞都要快。放射疗法采用特殊设备产生的高剂量射线照射癌变的肿瘤,杀死或破坏癌细胞,抑制它们的生长、繁殖和扩散。虽然一些正常细胞也会受到破坏,但是大多数都会恢复。与化疗不同的是,放疗只会影响肿瘤及其周围部位,不会影响全身。
1、放射杀伤癌细胞的机制
人们对手术和吃药打针治疗癌症的方式能做到直观了解,故比较熟悉,但对放射杀癌的作用就不是那么清楚了。放疗之所以能发挥抗癌作用,是因为放射线承载着一种特殊能量,称为辐射。众所周知,辐射在自然环境中可以诱发癌变,而对于放疗,辐射作为癌症的"杀手"。当一个细胞吸收任何形式的辐射线后,射线都可能直接与细胞内的结构发生作用,直接或间接地损伤细胞DNA。
(一)放疗机制
直接损伤 主要由射线直接作用于有机分子而产生自由基引起DNA分子出现断裂、交叉。
间接损伤 主要由射线对人体组织内水发生电离,产生自由基,这些自由基再和生物大分子发生作用,导致不可逆损伤。两种效应有同等的重要性。
(二)肿瘤吸收剂量
既然放疗的作用就是通过射线与癌细胞间能量的传递,引起癌细胞结构和细胞活性的改变,甚至杀死癌细胞,因此人们关心肿瘤组织内能量吸收的多少,即肿瘤的吸收剂量,这与疗效有关。
射线的性质用射线的质和量来描述:
a、射线的质:表示射线穿透物质的能力,称射线的硬度,用能量表示,如MV、MeV;
b、射线的量:表示放射线的强度,用居里或贝柯勒尔(Bq)表示。
射线的质和量决定于不同放射源(或放疗机)的选择。
射线与物质的相互作用。
吸收介质的性质:不同组织(或肿瘤)吸收程度差异较大。吸收剂量单位过去用拉德(rad),现用戈瑞(Gy)表示,且1Gy=100rad。
(三)肿瘤细胞的变化
放疗过程中,肿瘤细胞群(瘤体)内会发生一系列的复杂变化,有的癌细胞死亡了,被消灭了;有的仅仅是"挂了彩",日后还会死灰复燃,卷土重来。科学家将这些变化归纳为放射治疗的4个"R"(因下列4项名称的第1个文字母均为R):
放射损伤的修复 受到致死损伤的细胞将发生死亡。而射线引起的所谓亚致死损伤及潜在致死损伤的细胞,在给予足够时间、能量及营养的情况下,可以得到修复又"偷偷"活下来。
氧和再氧合作用 氧在辐射产生自由基的过程中扮演重要角色,细胞含氧状态对放疗杀伤作用有很大影响。放疗对乏氧细胞杀伤力就减弱,对氧合细胞杀伤力明显增强。肿瘤组织常有供血不足及乏氧细胞比率高的问题,部分癌细胞可逃避放射损伤,这是放疗后肿瘤再生长及复发的常见原因之一。放疗中,也有原来乏氧的细胞可能获得再氧合的机会,从而对放疗的敏感性增加。
细胞周期的再分布 癌细胞群的细胞常处于不同的细胞增殖周期中,对射线敏感也不一致。最敏感的是M期细胞,G2期细胞对射线的敏感性接近M期,S期细胞对射线敏感性最差。对于G1期的细胞来讲,G1早期对射线的敏感性差,但G1晚期则较敏感。放疗的敏感细胞被清除;引起癌细胞群中细胞周期的变动(再分布)。
细胞再增生 放疗后细胞分裂将加快,肿瘤组织生长也比较快。考虑细胞有再增生作用,放疗需要延长疗程,增加总照射量,才能达到更满意的治疗效果。了解了上述癌细胞的"动向",有利于改进放疗技术,更多的杀伤癌细胞。
2、放射治疗的临床应用
(一)根治性放疗
根治性放疗指应用放疗方法全部而永久地消灭恶性肿瘤的原发和转移病灶。放疗所给的肿瘤量需要达到根治剂量。对放射线敏感及中度敏感的肿瘤可以用放射治疗根治。在这类肿瘤的综合治疗方案中,放疗也起到主要作用。
(二)姑息性放疗
姑息性放疗是指应用放疗方法治疗晚期肿瘤的复发和转移病灶,以达到改善症状的目的。有时将姑息性放疗称为减症放疗,用于下列情况:
止痛 如肿瘤骨转移及软组织浸润等所引起的疼痛。
促进溃疡性癌灶控制 如伴有溃疡的大面积皮肤癌、口腔癌、乳腺癌等。
改善生活质量 如通过缩小肿瘤或改善症状后使生活质量提高。
(三)辅助性放疗
辅助性放疗是放疗作为综合治疗的一部分,应用放疗与手术或化疗综合治疗,提高病人的治疗效果。在手术或化疗前后,放疗可以缩小肿瘤或消除潜在的局部转移病灶,提高治愈率,减少复发和转移。
(四)肿瘤急症放疗
上腔静脉压迫综合征 病人临床表现为面部水肿,发绀,胸壁静脉及颈静脉怒张,上肢水肿,呼吸困难不能平卧休息等。引起上腔静脉压迫综合征的肿瘤,肺癌占75%~85%,恶性淋巴瘤占11%~15%,转移瘤占7%,良性肿瘤占3%。此时应立即给予放射治疗,缓解病人的症状,减轻病人的痛苦。症状缓解后改为常规放疗。
颅内压增高症 颅内压增高症会导致脑实质移位,在张力最薄弱的方向形成脑疝,造成病人神经系统致命性损伤而猝死。其临床表现为头痛、呕吐、视觉障碍,甚至精神不振、昏睡、嗜睡、癫痼发作。放射治疗最适于白血病性脑膜炎及多发性脑转移瘤引起的颅内压增高症的急症治疗。同时使用激素及利尿剂,能够使病人症状得到缓解,恢复一定的生活自理能力。
脊髓压迫症 脊髓压迫症发展迅速,一旦截瘫很难恢复正常。原发性或转移性肿瘤是脊髓压迫症的常见原因,肺癌、乳腺癌、前列腺癌、多发性骨髓瘤和,淋巴瘤最易转移至脊椎,导致脊髓压迫。95%以上的脊椎转移瘤均在髓外,对不能手术的髓外肿瘤应尽快采取放射治疗,同时也应使用大剂量皮质类固醇,促使水肿消退,防止放疗水肿发生。这种快速照射法通常可使多数病人疼痛明显减轻,症状缓解。
骨转移剧痛 骨转移的放射治疗的止痛作用既快又好,同时也有延长生存的作用。
六、放射敏感性及其影响因素
组织对一定量射线的反应程度,称为放射敏感性,不同组织器官以及各种肿瘤组织在受到照射后出现变化的反应程度各不相同。放射敏感性与肿瘤细胞的增殖周期和病理分级有关,即增殖活跃的细胞比不增殖的细胞敏感,细胞分化程度越高放射敏感性越低,反之愈高。此外,肿瘤细胞的氧含量直接影响放射敏感性,例如早期肿瘤体积小,血运好,乏氧细胞少时疗效好,晚期肿瘤体积大,瘤内血运差,甚至中心有坏死,则放射敏感性低;生长在局部的鳞癌,较在臀部和四肢的肿瘤血运好,敏感性高;肿瘤局部合并感染,血运差(乏氧细胞多),放射敏感性下降。因此,保持照射部位清洁,预防感染、坏死,是提高放疗敏感性的重要条件。
不同肿瘤及正常组织的放射敏感性
相对敏感度 肿瘤 正常组织
高度 淋巴类肿瘤、白血病、精原细胞瘤 淋巴、骨髓、睾丸、卵巢、肠上皮
中等高度 鳞癌:口腔、鼻咽、食管、膀胱、皮 肤、宫颈癌等
口腔、皮肤、角膜、毛囊、皮脂腺、食管、膀胱、晶状体、阴道、子宫
中度 血管及结缔组织肿瘤 一般结缔组织、神经结缔组织、生长软骨及骨组织
成熟软骨、骨组织,粘液唾液腺上皮、汗腺上皮、鼻咽上皮,肝、肾、甲状腺,肾上皮
另外,放射治疗的敏感性还受下列因素的影响:如细胞的分化程度、临床分期、既往治疗、肿瘤生长部位及形状、有无局部感染、病人营养状况或有无贫血等等。
放射反应护理
1、全身反应
由于肿瘤组织崩解、毒素被吸收,在照射数小时或1~2天后,病人可出现全身反应,表现为虚弱、乏力、头晕、头痛、厌食,个别有恶心、呕吐等,特别是腹部照射和大面积照射时,反应较重。护理措施:
(1)照射前不宜进食,以免形成条件反射性厌食。
(2)照射后完全静卧休息30分钟。
(3)进清淡饮食,多食蔬菜和水果,并鼓励多饮水,促进毒素排出。
(4)参加集体文娱活动或气功,以转移注意力。此外,每周检查血象1次,当白细胞下降至4×109L、80×109L以下时,需给升血药物,如血象明显下降需暂停放疗。
2、皮肤反应
皮肤对射线的耐受量与所用放射源、照射面积和部位有关。钴60治疗机和直线加速器产生的r射线和高能X线透力强,皮肤受量小,反应轻;X线治疗机产生的低能X线和感应加速器产生的电子束皮肤受量大,反应重。临床上大面积照射时或照射皮肤的皱褶及潮湿处,可出现一定程度的皮肤反应,皮肤反应分为三度:
(1)Ⅰ度反应:红斑、有烧灼和刺痒感,继续照射时皮肤由鲜红渐变为暗红色,以后有脱屑,称干反应。
(2)Ⅱ度反应:高度充血,水肿、水泡形成,有渗出液、糜烂,称湿反应。
(3)Ⅲ度反应:溃疡形成或坏死,侵犯至真皮,造成放射性损伤,难以愈合。
放疗后数日或更长时间,照射部位可出现皮肤萎缩,毛细血管扩张、淋巴引流障碍、水肿及深棕色斑点、色素沉着,称后期反应。
照射野皮肤保护措施:
①内衣宜柔软、宽大,吸湿性强。
②保持乳房下、腋窝、腹股沟及会阴部皮肤清洁干燥,防止干反应发展为湿反应。
③照射野皮肤应用温水和柔软的毛巾轻轻沾洗,忌用肥皂,不可涂酒精、碘酒、红汞、油膏,并避免冷热刺激(如热水袋)。
④照射野不可贴胶布,以免所含氧化锌(重金属)产生二次射线,加重皮肤损伤。
⑤头面部照射,防止日光照晒。
⑥使用电剃须刀,避免损伤皮肤,造成感染。
⑦皮肤脱屑期,切勿用手斯剥。
⑧发生干反应,可涂0.2%薄荷淀粉或羊毛脂止痒;湿反应可涂龙胆紫或氢化可的松暴露创面;如有水泡形成,涂硼酸软膏包扎1~2天,待渗液吸收后,再行暴露疗法。
3、粘膜反应
(1)口腔炎:口腔粘膜照射后可出现水肿、充血、溃疡、疼痛、唾液分泌减少、口干,以至出现假膜。护理措施:
①保持口腔清洁,每次饭后用软毛牙刷刷牙,每日用朵贝尔液含漱4次,出现假膜时改用1.5%双氧水。
②改少渣饮食,忌用刺激性调味品和过冷过热食物。
③如有剧烈疼痛,可在饭前喷以1%地卡因或用地卡因糖。
④口干可吃少量酸性食物,以刺激唾液分泌,并用抗口干牙膏刷牙。
此外,为预防放射后期发生骨髓炎或骨坏死,治疗前需洁齿并治疗牙疾,治疗后3年内不可拔牙。
(2)食管炎:食管照射后可出现粘膜充血、水肿及炎症,使食管梗阻加重,造成下咽困难、疼痛、粘液增多。
应保持口腔和食管的清洁,每次饭后喝温水冲洗食管。高度梗阻需行胃造瘘或静脉高营养。中、晚期食管癌,特别是溃疡型,粘膜坏死易造成穿孔;中段食管癌有穿入主动脉引起大出血的可能。因此,应密切观察病人有无呛咳、痛疼及脉搏的变化,早期发现出血和穿孔,以免延误抢救。
(3)直肠炎:全腹或盆腔照射时,可出现粘膜溃疡、腹胀、腹痛、腹泻等,甚至坏死组织脱落,引起大出血和肠穿孔。注意病人有无血性粘液便、里急后复放射性直肠炎发生,以及肠穿孔,大出血及休克。
(4)膀胱炎:膀胱照射后可引起毛细管扩张而出现尿频、尿急、血尿等膀胱炎症状,放疗后期膀胱缩小。应鼓励病人多饮水,以达自然冲洗膀胱并预防感染目的。
4、放射性肺炎和肺纤维变
胸部照射后可发生放射性肺炎。轻者无症状,急性放射性肺炎伴有高热、胸痛、咳嗽、气急等。需立即吸氧,静滴氢化可的松和抗生素。上呼吸道感染是其诱因,应注意保暖,预防感冒。放疗后期可出现进行性肺纤维变,表现为气短、干咳,需对症处理。
5、放射性脊髓炎
脊髓受较大剂量照射后会出现脊髓损伤,多发生于放疗后数月至数年内,开始表现为渐进性、上行性感觉减退,行走或持重乏力,低头时如触电感,逐渐发展为四肢运动障碍,反射亢进、痉挛,以至瘫痪。
治疗时需给予大量维生素B族神经营养药物、激素和血管扩张药,配合针灸、中医治疗;按截瘫病人护理。
放射防护的基本原则
为保护工作人员免受射线的伤害,国家制定的放射防护条例规定最大允许量为5Rem(测量放射人员受量单位)。放射防护的基本原则是:
1、减少受照剂量
照射量与源的放射性强度成正比。在不影响工作的情况下,应尽量减少操作人员的受量,使其在国家制定的允许标准之内。
2、缩短受照时间
照射量随接触时间而增加。在保证医疗质量条件下,工作宜迅速,减少在其周围的停留时间。
3、增加辐射距离
照射量与距离的平方成反比。可利用长柄工具或机械手远距离操作,减少放射量,从而起到保护工作人员的作用。
4、增加防护屏蔽
利用防护屏障可有效地减低照射量。
此外,放射工作人员应接受剂量监督,定期做保健检查。
肿瘤放射治疗技术新进展
放射肿瘤学由于高科技的发展已取得了许多理论上和技术上的突破,下面简要介绍放射生物科学,生物等效剂量超分割以及三维调强立体定向放射等技术的进展。
1、放射生物学进展
1)放射生物学的进展以线性--平方模式(Linear-Quadratic model)来解释放射生物学中的反应,以α/β系数来预测放射治疗剂量时间疗效关系,为放射生物学开辟了较为广阔的天地。近年来深入研究了细胞周期,即增殖期(G1-S-G2-M)和静止期(G0)的关系,为此提出了4个R即是修复(Repair),再氧化(Reoxygenation)和再分布(Redistribution)和再增殖(Regeneration)作为指导放射生物中克服乏氧等问题的研究要点,放射生物学推进到目的明确,针对性强的有效研究中去。近年来在研究细胞修复和增殖中又进一步了解到细胞凋亡(Apoptosis)和细胞分裂(Mitosis)的关系后,提出了凋亡指数(AI)与分裂指数(MI)(Apoptosisindex/Mitosisindex)比来予测放射敏感性和预后,指导调发自发性凋亡和平衡各种细胞的抗放、耐药(即Resistant RT和Resistant Chemotherapy),并由此估计复发,研究增敏,开发出超分割、加速超分割治疗等新技术,从而取得了科研及临床的许多新结果,加深了理论深度,开拓出新的领域,推动了放射治疗学的进展。
2)DNA和染色体研究
为了测定肿瘤细胞本身辐射损伤,染色体中DNA链中的断裂(单链断裂SSB和双链断裂DSB),其断裂的准确位置,以及在这个过程中,肿瘤细胞如何进行修复,也观察到错误修复,以及无修复等对细胞的子代产生的决定作用。目前临床用对DNA调节机制的多种原理表达进行测试,可以分清那些是有意义的表达,那些是灵敏的表达,建立对临床治疗,预后评估的方法学和化验项目,指导放射生物学,放射物理学,临床放射肿瘤学的发展,使更有目的性,针对性和实用性。放射生物学从细胞水平已进入到大分子水平,从纯实验室过渡到临床初步应用阶段〔5,6〕。
2、放射物理技术的进展
1)立体定向治疗的实现
基于电子计算机精度提高,双螺旋CT及高清晰度MRI出现,因此立体定向治疗应运而生,目前使用的γ-刀,从某种意义来说是一个立体定向放射手术过程(Sterol Radiation Surgery, SRS),它通过聚焦,等中心照准,于单次短时间或多次较长时间给予肿瘤超常规致死量治疗,达到摧毁瘤区细胞的目的,γ刀利用约30~200个钴源,在等中心条件下,从立体不同方向位置,在短距离内对细小肿瘤(或良性肿瘤,先天畸形等病灶,一般约1~2cmΦ)进行一次或多次照射,给予总剂量超过肿瘤及正常组织耐受量,用准确聚焦的办法使多个60Co源的剂量集中在靶区,分射束聚焦使周围正常组织受量仍在可能的耐受量中,由于采用电脑、CT,以及准确的立体设计定位,因而射野边界锐利可达±2mm以下,确保了非瘤区正常组织安全。应用于脑部的良性小肿瘤和先天性畸形效果尤佳,应用于脑干等生命禁区也取得了效果。但目前许多单位滥用,不严格控制适应症,因此造成了许多后遗症和并发症,使γ-刀的应用与初始设计原意偏离了轨道。
此外,采用X刀(加速器)其应用电脑进行定位,聚焦等技术与γ刀原理相近,它除应用在头部肿瘤(如γ-刀)外,还应用在胸、腹盆等区域,应用范围比γ-刀广,应用效率较γ-刀要好。但立体照射(γ,X刀)技术应用中还存在许多问题,如放射生物学中的远期并发症,肿瘤的局部控制问题,远处转移仍未得到解决,因此想单靠一种这样机器是不能完全解决放射治疗的所有问题的。
2)三维适形放疗技术
3-Dimension Conformal Radiation Therapy(即3-D CRT),其理论和物理技术基础与γ-刀等大同小异。但近年来特别强调的由平面二维定位,过渡到立体三维定位,与其相适应的光栅(遮光器)能够随射野改变而适形变化,达到准确适应肿瘤形状,使高剂量区分布形状在三维方向上与病变靶区完全一致,适形和三维是一个问题的两个方面,没有三维定位则适形也无从实现,没有多叶光栅(multiple leaves collimator),以及其随体位、肿瘤空间形态改变的适形照射也是一句空话。近年来开发出了立体定向X-刀电子计算机芯片设计程序突破了芯片对多叶光栅同步控制的适形变化部分,使3DCRT就已经步入了实用阶段,它可以通过常规分割,超分割,加速超分割,以及低速分割(Hypo fraction)等治疗方式来完成目前一般的常规放疗机(加速器,钴60机,γ-刀等)所不能完成的任务。无论其精确度、疗效,并发症均优于常规治疗机,国外一些人士称它为21世纪的常规放疗机。它使射野(单个、多个、运动、固定)形状与病变靶区的投影保持一致,多叶光栅对射野内诸点的输出剂量率按要求不断进行调整。
3)调强适形放疗(Intensity Modulation Radiation Therapy-IMRT)
这种技术目前仍已应用于临床,但国内外同行评价这种技术为21世纪放射治疗技术的主流。三维适形治疗(3-DCRT)所采用的同步可控多叶光栅,三维适形定位这种技术在IMRT中已成为基础技术。但其不同之处在于采用(1)逆向算法设计(Inversereckon Planning),这是IMRT除三维适形之外,为更精确起见所插入的必要步骤,它不仅正面方向的精确剂量计算,而且从逆方向算法来进行验证和审核,使用的高能X线,电子束、质子束等放射源,其射野绕人体用连续或固定集束,在旋转照射方向上达到更精确边界,因而它可以提高强度,达到适应肿瘤形状高输出剂量,三维数字图象重建(3DRR-3Dimension Reckon-Picture Reconstruction)功能,使三维图象中靶区等重要器官与图象吻合,剂量分布合适与否一目了然。
a、有冠状、矢状、横断面的图象及剂量分布,还要能给出任意斜切面的图形及剂量分布,并随时可以显示给治疗人员,设计人员以及医生,它使视野方向的观视(BEV Beam-field Equation Vision)和医生反方向的观视(REV-Reaction Equation Vision)都成一致。
b、模拟选择--在安排和设计射野时必须具有模拟类似常规模拟定位机射野的选择功能,包括准直器种类,(独立式、对称式)和多叶准直器即多叶光阑(LMC-Multiple leaves collimator),大小,放置射野档块和楔形过滤板等。
c、治疗方案确定后,将各项条件输入CT模拟治疗(CT-Simulator),CT的模拟机应能接受上述条件。
d、验证,择优方案选择后将信息转至治疗机电脑按上述条件运转,将各种附加条件如机架,准直器,床移动范围,射野大小,多叶光栅叶片运动及调整机匹配,这样整个过程就完成了。所谓调强适形放射技术就是从固定视野上的物理条件出发,把其准确性调至最高,将平面二维准确调至三维更准确方向,在三维补偿照准方面调至最精确,给到最大足量。从诊断、设计实施和多种补偿手段,各种运动射束的调强,使射野边界锐利,界限明确,达到最高限度的准确定位,最高准确剂量达到靶,高准确度执行预定计划,从而可以超过SRT及SRS的准确治疗方式,又可克服SRT及SRS的明显缺陷。
4)图像导引放射治疗-IGRT
这是目前肿瘤放射治疗的发展的方向。其目的是在同一台治疗设备上做到精确计划(TPS)、精确定位(IGRT)、精确治疗(IMRT)三原则。目前美国VARIAN、德国SIEMENS、瑞典ELAKAT都具备这方面的能力。我国的医用加速器与此上有一定的差距,但是相信很快也能赶上并超过他们。
3、临床实用放疗技术进展
1)生物等效剂量(BED-Biological Equralent Dose)
为了使肿瘤中心物理剂量与其他点的剂量差异(即剂量不均质性);以及物理剂量与生物效应之差异(也称为生物效应差异),这双重差异的结果能最后表达出来,在放射生物学上对这种双重差异效应统一,称之为生物等剂量(BED),过去临床医生仅凭经验及临床效果来猜测,它要达到对肿瘤区的根治剂量,又要对周围正常组织的保护,为了使BED应用于临床实际,以往L-Q模式α/β比能够大致表达这种内容。在低剂量区起始段为细胞杀灭与剂量成线性关系(e-ad)为单靶区域α击中;随着剂量增加存活曲线向下弯曲,此时细胞存活和剂量成平方关系(e-βd2),通过线性(α/β值约为10Gy)。利用这个理论及实验室结果,使治疗中生物等效剂量更接近临床治疗中实际,以往在治疗中应用的常规分割(每周五次,每天一次,每次剂量约2Gy)这个矢量对肿瘤的控制,它的生物等效剂量比较好,但不理想。因此为了接近肿瘤实际故又提出了肿瘤可控机率TCP(Tumor Contral Probability)和不可控机率NTCP(Non Tumor Control Probability),以TCP/NTCP数值来衡量BED和肿瘤治疗机率。
2)超分割(HF,Hyperfraction),加速超分割,(AF,Acceleated Hyperfraction)和低分割(Hypofraction)技术在临床上的应用
以往我们常用常规分割——即每周五天,休息二天,每天一次,每次剂量约2Gy,这已用了几十年的方法称为常规分割(Convention fraction)其原理在于五天放射,二天休息,每周共五次是较为合适的治疗,它使肿瘤受损达到较高程度,但又使靶区内的正常细胞有可能得到部分修复,利用正常细胞与肿瘤细胞“受量耐受性差”作为治疗根据,但这种常规分割(CF),24小时重复一次,不论剂量调强到3Gy/次也好或更高,但有一定限度,连续4Gy/日高量则正常组织修复乏力,从临床动物试验结果看到,肿瘤细胞经过照射之后约4小时即已开始进行修复,因此每天一次照射至第二天再开始则受打击之肿瘤细胞,它通过4R(修复,再氧化,再分布和增殖)已经达到了一定水平的恢复。如果在其修复周期3~24小时之间,再给予一定的辐射打击,则可以加重其损伤程度和减少修复百分比,使致死性损伤更多,双链断裂(DS更多,使阻于G1期的细胞减少。基于此近十几年来在国内外开展了超分割(HF)治疗,其基本条件为每天照射2次,每次间隔4~6小时每次剂量在1.1~1.4Gy之间,其余条件为:总剂量、每周五天均与CF无差别。经过十几年来试验和临床观察已看到了局部控制,复发率,生存率比CF有显著意义提高,其近期副作用比常规分割明显大,长期损伤和迟发反应明显后遗症和常规分割无显著性差别。这些结果国内外经过双盲随机,单盲随机,非随机回顾性对比均取得同一临床结果,动物实际结果也得到确认 加速超分割(AF,Accelerated Hyperfracton)其原理和基本出发点和规定与分割相同,但在每天放疗次数,每次剂量则有区别。它每天至少3次以上(偶有应用4次的报道)每次间隔3~4小时,3次剂量总和达3Gy以上(一般在4.5Gy以下),自80年代至开展AF以来其近期疗效和远期疗效均优于CF。其近期、远期并发症与HF相同,近期反应略大于HF。但无论超分割、加速超分割也好,都是建立在肿瘤细胞和正常细胞组织间的放射生物学特点差异基础上的,放射治疗剂量的提高,局部控制的好坏完全离不开这些基本条件,因此这种方法仍是有一定限度。在美国Anderson医院和一部分地区试用所谓:辅助野超分割治疗,(Hyperfraction Boost field),其方法为全程采用每天二次治疗中首次使用较大剂量,间隔4~6小时后加入辅助小野,抛开该大野中之淋巴预防区,其效果在于增加对原发灶打击,对淋巴区照射则限于常规分割剂量,增加原发灶的损伤。几年来试验结果,其优点明显,原发灶控制与HF和AF很接近,但近期反应较轻,很受临床欢迎。
3)传统的治疗
术前放疗仍在应用,过去多提倡术前给予常规治疗根治量的1/2~2/3后手术,由于术中粘连多,故有些试验降低术前放疗量为全量照射的1/3,如食管癌术前放疗由过去的GT30~40Gy降至30Gy以下再手术,日本学者的观察未发现其远地转移增多,但术后并发症少,生存率略有提高,因例数太少,无随机,故说服力不大。
应用超分割及加速分割作术前放疗已有尝试,但术后并发症多,与其近期副作用多是一致,故目前为术前作CF比做HF或AF多。
4、放疗其他新技术进展
对放射治疗的技术学和方法学研究以及基础理论研究,其中对于乏氧细胞和射线粒子的放射原理,放射生物学研究提供了一些基础,例如快中子对乏氧细胞的作用,高LEF射线的Bragg峰的优越物理生物作用的利用,重粒子的使用,都对放射治疗技术有很大吸引力,目前仍在不断地发展中,质子加速器是开重粒子治疗的先河,目前已有质子加速器应用于临床上。高LET射线物理防护,远期放射生物效应,后遗症等也不可忽视。精确定位,精确设计,精确治疗的统一应用是肿瘤放射治疗技术的必然发展趋势,也是从事放射治疗工作的追求目标,21世纪给放射新技术既提出了机遇也提出了挑战,让我们面对这种形势努力创造条件,提高档次和水平,追赶世界先进潮流,达到更高水平。
肿瘤治疗中许多学科互相交叉,互为借鉴,目前血液病学和化学治疗中提出了高剂量化疗或全身放疗来杀灭全身的恶性细胞,其中全身放疗(TBI,Total Body Irradiation)在血液病骨髓侵犯病人中应用比较成功。为此许多人认为对于容易转移的实体瘤,如未分化癌,原发灶较小的癌肿采用癌灶区加全身放疗再加以骨髓移植或干细胞移植(Stem Cell Transplant)作为对付这种疾患的办法。目前在国外(日、美、法、英)有个别研究,先将周围血中或骨髓中的干细胞在未治疗前抽出分离保存,再给予原发灶的根治性治疗,后采用TBI或HDC(Hyper-Dose Chemotherapy)治疗使WBC达到接近0,再在层流病房将原病人的干细胞(周围血或骨髓血)返输,配合应用G-CSF(Granulocyte Colony Stimulation factor)集落刺激因子,渡过白血球减少的感染关,期望达到痊愈,以使潜在于骨髓、脾脏器官中的隐蔽恶性肿瘤细胞无藏身之处,达到防止转移根治痊愈目的。由于小灶性的分化差肿瘤采用此种办法代价很大。故往往不易被患者所接受,但目前尚有个别试验成功例子。作为一种新的方法目前仍未全面应用临床,但从理论和实际上是有探讨及研究价值的余地。但对于已广泛转移的实体瘤应用这种方法应该是没有效果的。从这一方法的侧面借鉴,使肿瘤整体治疗取得更大的效果,这也是放射治疗应该注意的问题。
放疗有何缺点
肿瘤治疗中,主要手段是手术、放疗和化疗; 放疗虽然有很多的优点,但缺点也不少。放疗不能减轻化疗的毒性作用,化疗也不能减少放疗的损伤作用,如化疗抑制全身的骨髓,放疗也产生局部的骨髓抑制,病人常常因骨髓抑制血相低而无法继续治疗。在做胸部肿瘤放疗时,化疗后的病人放射性肺炎或肺纤维变、放射性心包炎的发生明显增多,有时不得不减少放疗剂量,增加了放疗的难度。化疗对肝肾胃肠道的毒性很大,放疗对这些部位的损伤也相当大,所以综合治疗时,放疗的剂量受到很大限制,对不敏感的肿瘤难以提高剂量,效果就差。化疗后对身体免疫力影响也较大,身体情况也受到很大损伤,使放疗时无法用较大的治疗野。所以,综合治疗时应尽量选择对所放疗脏器毒性小的化疗药物。
放射物和辐射病专题
主条目: 辐射
放射线 从原子核中放射出来的有穿透性的粒子束。最常见的有α射线、β射线、γ射线、X射线(伦琴射线) 等
辐射强度单位是贝可勒尔(becquerel)简称贝可。比活度指放射源的放射性活度与其质量之比。
辐射相关症状和疾病:
环境问题: 放射性废物
相关图书:
| 关于“放射治疗”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |