阿法替尼
| A+医学百科 >> 阿法替尼 |
 |
|
|---|---|
| IUPAC命名 | |
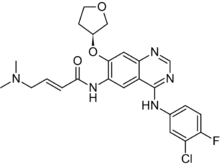
| N-[4-[(3-Chloro-4-fluorophenyl)amino]-7-[[(3S)-tetrahydro-3-furanyl]oxy]-6-quinazolinyl]-4(dimethylamino)-2-butenamide | |
| 识别 | |
| CAS号 | 439081-18-2 |
| ATC编码 | L01XE13 |
| PubChem | CID 10184653 |
| ChemSpider | 8360155 |
| UNII | 41UD74L59M |
| ChEBI | CHEBI:61390 |
| ChEMBL | CHEMBL1173655 |
| 异名 | BIBW 2992 |
| 化学性质 | |
| 化学式 | C24H25ClFN5O3 |
| 分子量 | 485.937 g/mol |
| SMILES | 搜寻Jmol 3D模型,eMolecules,PubChem |
|
|
| 药代动力学性质 | |
| 生物利用度 | 92%[1] |
| 蛋白结合 | 95% |
| 代谢 | CYP not involved |
| 半衰期 | 37 hours |
| 排泄 | Faeces (85%), urine (4%) |
| 治疗考量 | |
| 许可资料 | EMA:连结, US FDA:连结 |
| 怀孕分级 | C (澳) D (美) |
| 合法状态 | 限医师处方 (S4) (澳) ℞-only (加) POM (英) ℞-only (美) |
| 途径 | Oral |
阿法替尼(英语:Afatinib),是一种创新的抗癌标靶治疗药物,即新一代口服标靶药,为全球首种不可逆转地结合ErbB家族(包含四种不同的癌细胞表皮生长因子受体,如 EGFR、HER2、 ErbB3 及 ErbB4)的抗癌标靶药,进而更有效地及针对性地阻断引发癌细胞生长的讯号,减少或延缓癌细胞的增生。阿法替尼已在美国、欧洲和台湾多国家地区获批用作为一线治疗药物[2] ,应用于具有表皮生长因子受体(英语:EGFR)突变癌细胞的非小细胞肺癌(英语:NSCLC)治疗,是每日一次的口服标靶治疗药物。
阿法替尼由德国药厂勃林格殷格翰研发,经过多项大型临床验証,被FDA评为突破性治疗[3]。世界权威学术杂志《自然》亦指出“阿法替尼”于2013年成为全球正面的头条新闻之一。阿法替尼于2013年在美国及欧洲上市,商品名称分别为“Gilotrif”及 “Giotrif”;中文商名在台湾及香况分别为“妥复克”及“标必达”(英语:Giotrif),香港及中国的正式批刻使用现正于审核中[4]。
通过抑压上述ErbB家族的信号传导,对于防止肿瘤生长和扩散担当关键性的角色。阿法替尼的作用能不可逆转地与ErbB家族受体结合,中断下游信息传导,从而阻止癌细胞生长,并诱导癌细胞凋亡(程序性死亡)。 因此,相比其他标靶药物,阿法替尼与ErbB家族受体不可逆转地结合的特性能够提供更具持久、选择性、共价及完全地中断通过癌细胞的信息传导,从而带来独特的抗癌治疗效益,更具潜力去抑制广泛类别的肿瘤细胞增长,其疗效亦更显注[5][6][7]。
目录 |
作用机制
阿法替尼为不可逆转的ErbB家族阻断剂,能抑压信息传导和阻隔与癌细胞生长和分裂相关的主要通道。由于通过ErbB家族信息传导机制可由多个同二聚体跟异二聚体引发,所以同时抑制多个ErbB家族成员(如 EGFR, HER2, ErbB3 及 ErbB4),能较有效地中断下游信息传导[8]。
于癌细胞中,ErbB家族的运作经常失调。当控制细胞生长机制的因子过度表现或运作异常,有机会引发各种实质固态肿瘤。受体过度表现会刺激细胞内部信息传导超越正常水平,引致不受控的肿瘤细胞增长、迁移和转移及抑制其凋亡[9]。引发以上细胞信息传导异常的情况有以下各种不机制﹕受体变异(例如﹕肺癌肿瘤EGFR变异)、受体过度表现(例如﹕乳癌肿瘤HER2过度表现)或配体(ligand)过度表现[10]。
审批和使用
基于在临床研究的取得突破性疗效结果,阿法替尼早前被纳入美国食品及药物管理局(FDA)优先审核流程[11]。FDA优先审核流程将为那些安全、有效、尚无满意的替代治疗选择、而且相较于目前上市的产品具有显著改善优势的药物提供快速审核的通道,以加快提供突破性的药物予有需要的患者。
阿法替尼于 2013年7月12日获美国食品及药物管理局(FDA)核准上市,作为新型一线治疗药物,应用于通过经FDA批准的检测方法检出存在表皮生长因子受体(EGFR)外显子19缺失突变或外显子21(L858R)替代突变的转移性非小细胞肺癌(NSCLC)患者[12]。
欧盟药物管理机构(European Medicines Agency)亦于2013年7月25日核准“阿法替尼”用于医治因表皮生长因子受体(EGFR)突变的非小细胞肺癌(NSCLC)患者[13]。
中华民国行政院卫生署食品药物管理局(TFDA)亦早于2013年5月17日抢先核准阿法替尼药物上市[14]。
主要研究发展
肺癌
LUX-Lung临床研究计划,现正探讨阿法替尼用于中晚期非小细胞肺癌患者的疗效。两个关键性的第三期研究﹕LUX-Lung 3(n=345)和LUX-Lung 6(n=364)为至今最大、最有力和最贯彻始终的临床注册研究计划,针对因EGFR突变而导致的晚期非小细胞肺癌。于2013年,LUX-Lung 3研究结果在临床肿瘤学杂志(Journal of Clinical Ontology)刊出[15][16],而LUX-Lung 6研究结果则在美国临床肿瘤学会(ASCO)周年会议上发表[17][18]。
美国临床肿瘤医学会(ASCO)官方年会发表的数据证明[19][20],病人经过崭新试验性化合物阿法替尼治疗后长达一年时间,其肿瘤才恢复生长,相反那些接受化学治疗 (吉西他滨gemcitabine / 顺铂cisplatin)的病人,不到六个月后肿瘤便复发。经过独立审查的肿瘤评估数据显示,阿法替尼的无疾病恶化存活期(PFS)是11个月, 相比化疗的PFS只有5.6个月更为优胜。此外,接受阿法替尼治疗的病人,接近一半(47%)于疗程一年后依然生存而且病情无恶化,而接受化疗的病人却只有2%维持这个状况。
作为LUX-Lung临床研究计划一部分,现时其有八项研究同时进行中,研究项目的设计皆以分析“亚法替尼”在中晚期非小细胞肺癌各种环境的疗效(包括出现EGFR突变的非小细胞肺癌患者和持续患病的患者)为目标。
其他癌症
阿法替尼亦被选作多种肿瘤类别研究用途[21],现正进行头颈癌等的晚期临床试验。
研究资料总览
疗效和安全性
LUX-Lung 3与LUX-Lung 6是多中心临床试验、随机化及开放标示的第三期研究,旨在比较“阿法替尼”和化疗(分别为培美曲塞pemetrexed/顺铂cisplatin 和吉西他滨gemcitabine / 顺铂cisplatin),用作一线治疗患上中晚期转移性、因EGFR突变的非小细胞肺癌患者[22] [23]
这些关键性的第三期研究提出有力证据显示阿法替尼相对传统化疗(分别为培美曲塞/顺铂和吉西他滨/ 顺铂),疗效更加卓越。此外,两份研究报告一致证明“阿法替尼”的疗效和安全性,进一步增强大家对研究成果的信心。
综合LUX-Lung 3与LUX-Lung 6的主要研究结果[24][25][26][27][28][29]
无恶化存活期 (PFS - 患者存活并且肿瘤没有再重新生长的时间)
| LUX-Lung 3 (阿法替尼 vs 培美曲塞pemetrexed/顺铂cisplatin ) | ! LUX-Lung 6 (阿法替尼 vs 吉西他滨gemcitabine / 顺铂cisplatin ) |
|---|---|
| 根据独立审查,所有出现表皮生长因子受器变种的患者(总数=345)﹕ 11.1个月 vs 6.9个月 | 根据独立审查,所有出现表皮生长因子受器变种的患者﹕11个月vs 5.6个月 |
| 根据独立审查,小组群中出现最常见变种的患者(总数=308,即病人总数90%,del19和L858R)﹕13.6个月vs 6.9个月 | 根据调查员审查,接受“亚法替尼”治疗的患者存活超过一年后,其肿瘤才恢复生长﹔相比之下,接受传统化疗的存活不过半年(无恶化存活期13.7个月vs 5.6个月) |
| 此外,接受“阿法替尼”治疗的患者有47%在疗程一年后仍然活着而并肿瘤无恶化,而接受传统化疗的患者出现同样状况的只有2%。 |
两个研究一致显示“阿法替尼”延迟肿瘤生长的功效,证明其疗效显著及研究资料可靠。
客观反应 (肿瘤萎缩)
| LUX-Lung 3 (阿法替尼 vs 培美曲塞pemetrexed/顺铂 cisplatin ) | LUX-Lung 6 (阿法替尼 vs 吉西他滨gemcitabine / 顺铂cisplatin ) |
|---|---|
| 根据独立审查,每两名接受亚法替尼疗程的患者中,有一位(56%)肿瘤萎缩,相比接受传统化疗的,四名患者中只有一位(23%)的情况有明显改善。 | 根据独立审查,67%接受“阿法替尼”疗程的患者,其肿瘤体积大为萎缩,只有23% 接受传统化疗的患者情况有如此大幅改善。 |
肿瘤萎缩亦有助改善疾病有关的征状。
与疾病有关的征状
两个研究结果均证明,较多接受“阿法替尼”疗程的患者,病征如呼吸困难、咳嗽和胸痛均得到改善。此外,“阿法替尼”疗程有助延迟这些征状出现。
生活质素 (患者问卷统计)
LUX-Lung 6与LUX-Lung 3的研究结果,一致证明接受“阿法替尼”疗程的患者相比接受传统化疗的患者,享有更高的生活质素(例如﹕工作和日常起居活动)。
Grade =3不良事件
| LUX-Lung 3 (阿法替尼 vs 培美曲塞pemetrexed/顺铂cisplatin ) | LUX-Lung 6 (阿法替尼 vs 吉西他滨gemcitabine / 顺铂cisplatin ) |
|---|---|
| 接受“阿法替尼”疗程后,最常见因药物引发的不良反应包括肚泻、皮肤过敏和甲沟炎 | 接受“阿法替尼”疗程后,最常见因药物引发的不良反应包括肚泻、过敏/痤疮、和口腔炎/口腔黏膜炎。 |
| 接受化疗后,最常见因药物引发的不良反应包括头晕呕吐,食欲下降和疲倦。 | 接受化疗后,最常见因药物引发的不良应包括嗜中性白血球低下(嗜中性白血球是白血球的一种,患者体内这种白血球数量不正常偏低)、呕吐和白细胞减少症(患者体内白血球数量减少)。 |
| 因不良反应中止疗程的比率偏低(阿法替尼的中止率为8%﹔化疗的为12%)。 | 因不良反应而中止“阿法替尼”疗程的患者比率为6%,而中止化疗的患者比率为40%。 |
| 接受“阿法替尼”治疗的患者中,有1%因肚泻而停止疗程。 | 接受“阿法替尼”疗程的患者,很少因药物不良反应而中止疗程,其中只有2%因过敏/痤疮中止疗程,当中没有病人因肚泻而中止疗程。 |
耐受性
“阿法替尼”的副作用大致上可管理和逆转的。直致目前为止,研究显示药物引致的不良反应大部分涉及肠胃(如肚泻)和皮肤(如过敏),这跟表皮生长因子受器酪胺酸激脢抑制剂有关。[30][31][32][33]
临床潜力
信号传导抑制剂为癌症研究中一个主要发展目标。“阿法替尼”其独特不可逆转结合的功能与具选择性地阻断癌细胞信息传导作用,可能有助改善多种癌细胞的抑制能力,从 而扩大癌症药物的潜在疗效。
现时发展阶段显示,“阿法替尼”可能优胜过其他耐受性相若(40mg剂量)的信号传导抑制剂。目前仍有很多有关“阿法替尼”的研究计划正在进行中,于未来将会提供更多临床资料,巩固“阿法替尼”于癌症治疗的效用。
参考文献
- ↑ Gilotrif (afatinib) dosing, indications, interactions, adverse effects, and more. Medscape Reference. WebMD [28 January 2014].
- ↑ Dungo RT, Keating GM.Drugs. 2013 Sep;73(13):1503-15.
- ↑ FDA Website. http://www.fda.gov/downloads/aboutfda/reportsmanualsforms/reports/userfeereports/performancereports/pdufa/ucm384035.pdf. Accessed in Feb 2014.
- ↑ http://www.worldpharmanews.com/boehringer-ingelheim/2318-fda-grants-priority-review-to-boehringer-ingelheims-afatinib-nda-for-egfr-mutation-positive-advanced-nsclc
- ↑ Hynes NE, MacDonald G. ErbB receptors and signalling pathways in cancer. Curr Opin Cell Biol 2009; 21:177-84.
- ↑ Reid A, Vidal L, Shaw H, do Bono J.Dual inhibition of ErbB1 (EGFR/HER1) and ErbB2 (HER2/neu). Eur J Cancer 2007;43:481-9.
- ↑ Solca F, Dahl G, Zoephel A, et al. Target binding properties and cellular activity of afatinib (BIBW 2992), an irreversible ErbB family blocker. J Pharmacol Exp Ther 2012;343:342-50.
- ↑ Reid A, Vidal L, Shaw H, do Bono J.Dual inhibition of ErbB1 (EGFR/HER1) and ErbB2 (HER2/neu). Eur J Cancer 2007;43:481-9.
- ↑ Hanahan D, Weinberg RA. The Hallmarks of Cancer. Cell,100(1), pp.57-70.
- ↑ Wieduwilt MJ, Moasser MM. The epidermal growth factor receptor family: biology driving targeted therapeutics. Cell Mol Life Sci 2008;65:1566-84.
- ↑ Drugs.com. U.S. FDA Grants Priority Review to Boehringer Ingelheim's Afatinib NDA for EGFR Mutation-Positive Advanced NSCLC. http://www.drugs.com/nda/afatinib_130115.html. Accessed on Feb 2014.
- ↑ U.S. Food and Drug Administration website: http://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm360574.htm. Accessed in Feb 2014.
- ↑ European Medicines Agency: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002280/WC500152394.pdf. Accessed in Feb 2014.
- ↑ 中央广播电台. http://news.rti.org.tw/index_newsContent.aspx?nid=424830. Accessed in Feb 2014.
- ↑ Yang J, Hirsh V, Schuler M, et al. Symptom Control and Quality of Life in LUX-Lung 3: A Phase III Study of Afatinib or Cisplatin/Pemetrexed in Patients With Advanced Lung Adenocarcinoma With Epidermal Growth Factor Receptor Mutations. J Clin Oncol 2013;DOI: 10.1200/JCO.2012.46.1764
- ↑ Sequist L, Yang J, Yamamoto N, et al. Phase III Study of Aaftinib or Cisplatin Plus Pemetrexed in Patients With Metastatic Lung Adenocarcinoma With Epidermal Growth Factor Receptor Mutations. J Clin Oncol 2013;DOI: 10.1200/JCO.2012.44.2806
- ↑ Wu, Y., MD. LUX-Lung 6: A randomized, open-label, Phase III study of afatinib (A) vs. gemcitabine/cisplatin (GC) as first-line treatment for Asian patients (pts.) with EGFR mutation-positive (EGFR M+) advanced adenocarcinoma of the lung. (Abstract #8016) at American Society of Clinical Oncology, Chicago, June 2, 2013.
- ↑ Geater, SL, MD. LUX-Lung 6: Patient reported outcomes (PROs) from a randomized open-label, Phase III study in 1st-line advanced NSCLC patients (pts.) harbouring epidermal growth factor receptor (EGFR) mutations. Poster (Abstract #8061) at American Society of Clinical Oncology, Chicago, June 1, 2013.
- ↑ Agus DB, Terlizzi E, Stopfer P, et al. A Phase I dose escalation study of BIBW 2992, an irreversible dual EGFR/HER2 receptor tyrosine kinase inhibitor, in a continuous schedule in patients with advanced solid tumors. J Clin Oncol 2006;24(18,Suppl):Abstract 2074.
- ↑ Mom CH, Eskens FA, Gietema JA, et al. Phase 1 study with BIBW 2992, an irreversible dual tyrosine kinase inhibitor of Epidermal Growth Factor Receptor 1 (EGFR) and 2 (HER2) in a 2 week on 2 week off schedule. J Clin Oncol 2006;24(18,Suppl):Abstract 3025.
- ↑ Li D, Ambrogio L, Shimamura T, et al. BIBW2992, an irreversible EGFR/HER2 inhibitor highly effective in preclinical lung cancer models. Oncogene 27:4702-11.
- ↑ Yang J, Hirsh V, Schuler M, et al. Symptom Control and Quality of Life in LUX-Lung 3: A Phase III Study of Afatinib or Cisplatin/Pemetrexed in Patients With Advanced Lung Adenocarcinoma With Epidermal Growth Factor Receptor Mutations. J Clin Oncol 2013;DOI: 10.1200/JCO.2012.46.1764
- ↑ Wu, Y., MD. LUX-Lung 6: A randomized, open-label, Phase III study of afatinib (A) vs. gemcitabine/cisplatin (GC) as first-line treatment for Asian patients (pts.) with EGFR mutation-positive (EGFR M+) advanced adenocarcinoma of the lung. (Abstract #8016) at American Society of Clinical Oncology, Chicago, June 2, 2013.
- ↑ Yang J, Hirsh V, Schuler M, et al. Symptom Control and Quality of Life in LUX-Lung 3: A Phase III Study of Afatinib or Cisplatin/Pemetrexed in Patients With Advanced Lung Adenocarcinoma With Epidermal Growth Factor Receptor Mutations. J Clin Oncol 2013;DOI: 10.1200/JCO.2012.46.1764
- ↑ Sequist L, Yang J, Yamamoto N, et al. Phase III Study of Aaftinib or Cisplatin Plus Pemetrexed in Patients With Metastatic Lung Adenocarcinoma With Epidermal Growth Factor Receptor Mutations. J Clin Oncol 2013;DOI: 10.1200/JCO.2012.44.2806
- ↑ Wu, Y., MD. LUX-Lung 6: A randomized, open-label, Phase III study of afatinib (A) vs. gemcitabine/cisplatin (GC) as first-line treatment for Asian patients (pts.) with EGFR mutation-positive (EGFR M+) advanced adenocarcinoma of the lung. (Abstract #8016) at American Society of Clinical Oncology, Chicago, June 2, 2013.
- ↑ Geater, SL, MD. LUX-Lung 6: Patient reported outcomes (PROs) from a randomized open-label, Phase III study in 1st-line advanced NSCLC patients (pts.) harbouring epidermal growth factor receptor (EGFR) mutations. Poster (Abstract #8061) at American Society of Clinical Oncology, Chicago, June 1, 2013.
- ↑ Plummer R, Vidal L, Li L, et al. Phase I study of BIBW2992, an oral irreversible dual EGFR/HER2 inhibitor, showing activity in tumours with mutated EGFR. Eur J Cancer Suppl 2006;4(12):173-4 (Abstract 573).
- ↑ Agus DB, Terlizzi E, Stopfer P, et al. A Phase I dose escalation study of BIBW 2992, an irreversible dual EGFR/HER2 receptor tyrosine kinase inhibitor, in a continuous schedule in patients with advanced solid tumors. J Clin Oncol 2006;24(18,Suppl):Abstract 2074.
- ↑ Plummer R, Vidal L, Li L, et al. Phase I study of BIBW2992, an oral irreversible dual EGFR/HER2 inhibitor, showing activity in tumours with mutated EGFR. Eur J Cancer Suppl 2006;4(12):173-4 (Abstract 573).
- ↑ Agus DB, Terlizzi E, Stopfer P, et al. A Phase I dose escalation study of BIBW 2992, an irreversible dual EGFR/HER2 receptor tyrosine kinase inhibitor, in a continuous schedule in patients with advanced solid tumors. J Clin Oncol 2006;24(18,Suppl):Abstract 2074.
- ↑ Mom CH, Eskens FA, Gietema JA, et al. Phase 1 study with BIBW 2992, an irreversible dual tyrosine kinase inhibitor of Epidermal Growth Factor Receptor 1 (EGFR) and 2 (HER2) in a 2 week on 2 week off schedule. J Clin Oncol 2006;24(18,Suppl):Abstract 3025.
- ↑ Eskens FA, Mom CH, Planting AS, et al. A Phase I dose escalation study of BIBW 2992, an irreversible tyrosine kinase inhibitor of epidermal growth factor receptor 1 (EGFR-1) and 2 (HER 2) in a 2 week on 2 week off schedule in patients with advanced solid tumors. Poster A235 presented at AACR-NCI-EORTC International Conference on Molecular Targets and Cancer Therapeutics, Philadelphia, PA, USA, 14-18 November 2005.
|
||||||||||||||||||||||||
参考来源
| 关于“阿法替尼”的留言: | |
给阿法替尼条目的留言--印度缘生堂 2017年10月6日 (五) 14:36 (CST) 留言: 阿法替尼 QQ2087828428 | |
| 添加留言 | |