逆转录病毒
| A+医学百科 >> 逆转录病毒 |
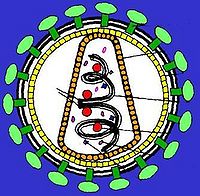
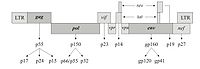
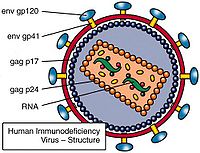
逆转录病毒即RNA病毒,需在逆转录酶的作用下首先将RNA转变为cDNA,新合成的cDNA插入宿主的核DNA中,随宿主DNA复制、转录、翻译达到扩增目的的一类病毒。逆转录病毒是RNA病毒,它有三个结构蛋白基因:gag-编码病毒衣壳、基质等结构蛋白的基因;pol-编码逆转录酶(p66/p51)、
蛋白水解酶和整合酶;env-编码gpl20和gp41两种包膜糖蛋白。有的逆转录病毒还带有癌基因(vonc),即有的逆转录病毒有致癌作用。近年来,已设计构建成一些缺陷型病毒(defective virus)使逆转录病毒成为有用的基因载体,成功地把抗药性基因转入了人体造血前体细胞,并在细胞中表达。Hock等选用了缺失编码病毒外壳蛋白基因的逆转录病毒,因此不能合成自身的外壳,但它有识别外壳蛋白进行包装的信号(一段尚未鉴定的DNA顺序)。用这种缺陷的逆转录病毒去感染某种细胞株,这种细胞株包含有辅助病毒(helper virus)。辅助病毒能合成蛋白外壳,但缺失了识别蛋白外壳进行包装的信号,因此它不能包装成病毒颗粒。当用逆转录病毒感染细胞株后,逆转录病毒的RNA进入辅助病毒的外壳蛋白,成为病毒颗粒。这时把受感染的细胞同骨髓细胞一起培养,包装在辅助病毒外壳蛋白中的逆转录病毒RNA,进入骨髓细胞,病毒DNA插入宿主细胞基因组,基因的活性得到表达。这时,由于骨髓细胞里面没有辅助病毒,所以整合进宿主基因组的逆转录病毒,不再有外壳蛋白可供包装,因此也就无法增殖,而只能被“陷”在宿主基因组中,通过细胞分裂而传给下一代子细胞。
1970年科学家在致癌RNA病毒中发现一种特殊的RNA病毒聚合酶,该酶能以RNA为模板,根据碱基互补原则,合成cDNA。这一过程与一般病毒转录方向相反,故称逆转录,催化此过程的酶称为逆转录酶,后来发现在哺乳动物的胚胎细胞和正分裂的淋巴细胞也含有。
逆转录病毒又称为携带逆转录酶的病毒,它先侵入宿主细胞以病毒RNA为模板,靠酶形成DNA环化,然后合到宿主细胞的染色体中去以原病毒形式在宿主细胞中一代代传下去。
目录 |
逆转录病毒分类
逆转录
按照目前国际病毒分类标准,逆转录病毒科分为7个属:
α逆转录病毒属 Alpharetrovirus
β逆转录病毒属 Betaretrovirus
γ反转录病毒属 Gammaretrovirus
δ反转录病毒属 Deltaretrovirus
ε反转录病毒属 Epsilonretrovirus
慢病毒属 Lentivirus
泡沫病毒属 Spumavirus
其中的慢病毒属又分为5个组,包括牛慢病毒组、马慢病毒组、猫慢病毒组、羊慢病毒组和人类慢病毒组。HIV在病毒“大家族”中的定位是逆转录病毒科慢病毒属中的人类免疫缺陷病毒组。
逆转录病毒和基因治疗
从1990年国施行第一例基因治疗计划到目前为止,全世界共有几百例临床计划在实施中。当初人们对基因治疗普遍寄予厚望,但结果却往往不尽如人意。人们意识到在基因组、基因的表达调控及疾病发生的机理没有彻底阐明之前,基因治疗还很难取得突破性进展。但基因治疗的出现,毕竟给我们治疗一些用传统疗法难以治愈的疾病带来了新的希望。
逆转录病毒载体
逆转录病毒的许多特点使其成为基因转移载体的上佳选择。最重要的一点是它可以有效的整合入靶细胞基因组并稳定持久地表达所带的外源基因。病毒基因组以转座的方式整合,其基因组不会发生重排,因此所携带的外源基因也不会改变。而另一类整合载体——腺相关病毒,以同源重组的方式整合,整合过程中病毒基因组发生重排,可能会影响到外源基因的结构与功能
如果能实现有效的基因转移,基因治疗在对付遗传性疾病、减缓肿瘤发展、战胜病毒性感染和终止神经系统退行性病变等方面都会有广阔的应用前景。这就要求在载体改造、载体的靶向性、外源基因的表达调控等诸多方面取得显著进展。基因转移载体可分两大类:病毒性载体和非病毒性载体。非病毒性载体的方法包括裸DNA注射、基因枪法、多聚赖氨酸或阳离子脂质体包裹DNA法等。一般非病毒性载体毒性成分少,且较安全。但它们存在共同的弱点:效率低且携带基因表达时间短。所以目前研究仍是一些病毒性载体,如逆转录病毒、腺病毒、腺相关病毒、慢病毒等。逆转录病毒应用最早,研究也相当成熟,目前仍被广泛应用。慢病毒也是一类逆转录病毒,它表现出的一些特点使人们对其逐渐产生了兴趣。逆转录病毒的许多特点使其成为基因转移载体的上佳选择。最重要的一点是它可以有效的整合入靶细胞基因组并稳定持久地表达所带的外源基因。病毒基因组以转座的方式整合,其基因组不会发生重排,因此所携带的外源基因也不会改变。而另一类整合载体——腺相关病毒,以同源重组的方式整合,整合过程中病毒基因组发生重排,可能会影响到外源基因的结构与功能。
逆转录病毒的靶向性
逆转录病毒可以与多种细胞表面蛋白结合而进入细胞,其宿主细胞范围很广。逆转录病毒的亲嗜性存在物种之间的差异,据此可将其分为三类:(1)单嗜性逆转录病毒(ectropic retrovirus),只感染小鼠和少数几个品种的大鼠;(2)兼嗜性逆转录病毒(amphotropic retrovius),能感染小鼠的细胞,也能感染其他种属动物的细胞;(3)异嗜性逆转录病毒(xenotropic retrovirus),能感染多种动物细胞,但不能感染小鼠细胞。目前使用较多的是兼嗜性逆转录病毒,即以兼嗜性包装细胞包装病毒颗粒。逆转录病毒的宿主范围由病毒颗粒表面的包被蛋白(Env)决定,病毒基因组不影响其靶向性,不同的基因组可用相同的Env包被,且Env来自何种病毒,包装出的病毒颗粒就叫该病毒的假病毒。
通过改变Env蛋白可以改变载体的靶向性。如用水泡性口炎病毒的G蛋白包装逆转录病毒基因组产生假病毒(pseudotype),可拓展逆转录病毒的靶细胞范围并赋予病毒颗粒新的特性。兼嗜性逆转录病毒一般结合细胞表面的磷酸转运体而进入细胞,但有一些重要的靶细胞:淋巴细胞、早期造血干细胞磷酸转运体的表达水平很低,而导致载体对其转导效率低下。G蛋白包装的假病毒则得有效感染这些细胞。这种假病毒还可以用超速离心进行浓缩达到很高的滴度(109 cfu/ml),普通的逆转录病毒只能达到106 cfu/ml;G蛋白还能抵抗人类补体的灭活作用,使其适于作体内(in vivo)的基因转移。
为提高逆转录病毒感染靶细胞的特异性,还可以在原来的病毒Env蛋白上接上一段具有特异靶向的多肽,目前应用较多的是单链可变区抗体(scFv)。如Martin等设计的特异靶向黑色素瘤细胞的逆转录病毒。他们在病毒包被糖蛋白的表面结构域(SU)上依次接上间质金属蛋白酶的酶切位点、一段富含脯氨酸的肽段及一段特异识别高分子量黑色素瘤相关抗原(HMW-MAA)的SCFU。90%的人黑色素瘤细胞高水平表达HMW-MAA这一穿膜分子,而绝大多数成人组织不表达。富含脯氨酸的肽段则暂时阻端SU和磷酸转运体的结合。肿瘤细胞表面还有高表达的间质金属蛋白酶,它在肿瘤细胞对正常组织的侵入中发挥重要作用。这样改造过的载体在SCFV的导向下达到肿瘤部位,肿瘤细胞表面的金属蛋白酸切去SU上的SCFV和脯氨酸肽段,SU和肿瘤细胞表面的磷酸转运体结合,进入肿瘤细胞,从而大大提高了载体靶向的特异性。
逆转录病毒载体感染非分裂细胞的探索
具有感染终末分化细胞的能力,高的转导效率和持续且可控制的基因表达是理想的基因治疗载体的三大特点。逆转录病毒虽具有后面两个优点,但不能感染非分裂细胞如肌肉、大脑、肺及肝组织中的这些可以做为基因治疗靶细胞的重要细胞。由于逆转录病毒的复制特点,它感染细胞时,细胞分裂需处于DNA合成阶段。因此有人尝试使用组织损伤或部分切除来诱导靶细胞分裂。例如肝脏部分切除可以极大地提高逆转录病毒在肝内的转导效率。
还有一种途径是利用一些基因的产物来诱导间歇期细胞进行DNA复制来增强逆转录病毒的感染。SV40的大T抗原可以诱导终末分化的肌肉细胞进行DNA复制和细胞分裂。表达温度敏感的大T抗原的肝细胞可被逆转录病毒高效感染。用巨噬细胞集落刺激因子(GMCSF)预先刺激间歇期细胞也可以大大增强逆转录病毒载体的感染效率。
逆转录病毒载体表达的调控
有人用ex vivo的方法,在肌细胞中表达IX因子,治疗小鼠血友病B。发现感染细胞回输小鼠后5~7d,IX因子的表达即被“关闭”了。证明不是由于细胞丢失、基因删除或免疫机制的原因。而可能是由于持续表达的外源基因诱导机体对其进行修饰而失去表达,因此要求基因在诱导物的作用下短暂表达,目前使用较多的有四环素诱导调控系统和雌激素诱导调控系统等。除此之外增强与启动子的正确组合也能避免基因表达被关闭。仍以上例,若用ATP肌酸磷酸转移酶的增强子——启动子来控制外源基因表达,只能得到低水平的表达,换用ATP肌酸磷酸转移酶增强子——巨细胞病毒启动子的嵌合载体,外源基因的表达可以持续两年。寻找载体调控元件的合理组合需长期摸索,在多基因载体中这种任务显得更加艰巨。
|
||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||
| 关于“逆转录病毒”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |