Γ-氨基丁酸A型受体
| A+医学百科 >> Γ-氨基丁酸A型受体 |
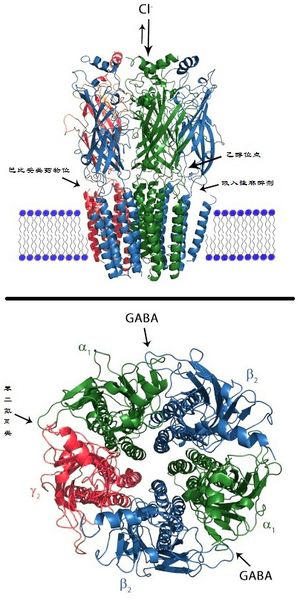
GABAA受体(又称作γ-氨基丁酸A型受体)是一种离子型受体,而且是一类配体门控型离子通道。此通道的内源性配体是一种被称为GABA的神经递质。GABA是中枢神经系统里的一种主要的递质,虽然GABA在神经递质的释放过程中产生的是抑制性效应,但GABA本身并非一种抑制性而是一种刺激性递质,因为GABA激活GABA受体的开放。在GABAA受体被激活后,可以选择性的让Cl-通过,引起神经元的超极化。这种超极化引起了神经信号传递抑制,因为降低了动作电位产生的成功率GABAA,在正常条件下产生的抑制性突触后电位的翻转电位是-75 mV,高于GABAB受体的-100 mV。
GABAA受体的活性位点可与GABA以及许多药物诸如蝇蕈醇、加波沙朵、荷包牡丹碱等结合。受体也包含许多异构调节,可间接调节受体活性,可调控异构位点的药物包括苯二氮䓬类、类苯二氮平类药物、巴比妥类药物、乙醇[2]、神经甾体、吸入性麻醉剂、印防己毒素等[3]。
药物导致GABAA受体对神经元活动的中度抑制可使患者消除焦虑感(抗焦虑作用),而更强的抑制作用则会产生全身麻醉。药物的严重过量鲜有出现,而产生的反应是延长麻醉时间,甚至出现死亡[4]。
目录 |
苯二氮䓬类位点
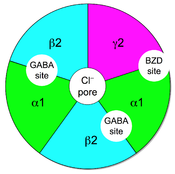
苯二氮䓬类药物可结合离子型GABAA受体蛋白复合物的靶点。苯二氮䓬类的靶点位置与内源性配体GABA的靶点位置不同,并非处于α和β亚基之间,而是一个特殊的苯二氮䓬靶点,这个靶点存在于含有α和γ亚基的受体中,位于α和γ亚基之间(如图所示)[5][6]。大部分的GABAA受体(含有α1,α2,α3或α5亚基的受体)对于苯二氮䓬类药物敏感,但少数含有α4或者α6亚基的受体对传统1,4- 苯二氮䓬类药物无敏感性[7],对其他类型的GABA能药物例如神经甾体和乙醇却存在敏感性。GABAA受体与外周苯二氮䓬受体(又称作转位子蛋白)并无关系。IUPHAR建议,不再使用过去的"苯二氮䓬受体", "GABA/苯二氮䓬受体" 及"ω受体" 等术语,并将"苯二氮䓬受体"更名为"苯二氮䓬靶点"[8]。
若一个GABAA受体对苯二氮䓬类药物敏感,该受体一定带有至少一个α 和一个γ亚基,使之形成苯二氮䓬靶点。一旦苯二氮䓬类药物与之靶点结合,可使GABAA受体固定于一种对GABA产生高亲和性的构型,该构型增加氯离子通道开放频率并以此让细胞膜超极化,加强了GABA对神经系统的抑制效应并引起镇静及抗焦虑效应。 不同的苯二氮䓬药物对GABAA受体有不同的亲和性,这种亲和性的不同是由受体的亚基不同所造成的。例如,与α1和/或α5亚基亲和力高的配体能产生更严重的镇静,共济失调和失忆症;对含有α2和/或α3亚基的受体产生更高亲和力的配体则会有更强的抗焦虑作用[9]。抗惊厥效果可以由任意一种亚基组合的受体中产生,但现在的研究主要集中于α2亚基选择性激动剂的方向,因为这种药物产生的副作用较小,而传统药物则会产生镇静,失忆等副作用。
苯二氮䓬类药物在GABAA受体的结合位点与巴比妥类药物以及GABA的位点都不相同[10],因此产生迥异的药效。苯二氮䓬类会引起氯离子通道开放更加频繁,而巴比妥类则增加氯离子通道的开放时间[11] 。因为两类药物的调节过程并不相同,两种调节可以同时发生,产生强效的协同作用,并可能使患者处于十分危险的境地。
另外,某些GABAA受体激动剂(如蝇蕈醇和加波沙朵会与受体上GABA位点结合,产生与苯二氮䓬类药物相似却不完全相同的效应。
结构与功能
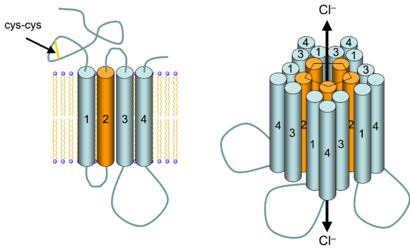
GABAA受体是由五个亚基组成的跨膜受体,五个亚基围绕形成离子通道。每个亚基包含四个跨膜域,N-和C-末端都在细胞外。GABAA受体存在于神经元的细胞膜上,大部分该受体处于突触后膜上,而某些受体的同源异构体也会出现在突触以外的地方[12]。GABA是GABAA受体的内源性配体,结合时可使受体通道开放。当GABA与受体结合时,受体在细胞膜上发生构型改变,通道孔打开,氯阴离子可顺着电势和浓度梯度通过离子通道。由于大多数神经元上的氯离子的翻转电位在细胞膜静息电位附近,或略低于静息电位,GABAA受体的激活可以使静息电位更加稳定,甚至使细胞超极化,以至于弱化了激动性神经递质的去极化效果和产生动作电位的可能。因此,该受体主要发挥抑制性作用,减少神经元的活动。GABAA受体是离子型受体,开放速度快,因此在抑制性突触后电位的过程中属于早期效应[13][14]。内源性苯二氮䓬类位点的配体是肌苷。
亚基
GABA受体是半胱氨酸环超家族的一员,半胱氨酸环超家族包含一些在进化上相关的并在结构上相似的配体门控离子通道如烟碱型乙酰胆碱受体、甘氨酸受体,5-HT3受体。GABAA受体包含许多同源异构体,不同的异构体决定了受体的配体亲和性,通道开放率,离子电导性等性质[15]。
在人体中,包含以下亚基[16]:
- 六种α亚基(GABRA1, GABRA2, GABRA3, GABRA4, GABRA5, GABRA6)
- 三种β亚基(GABRB1, GABRB2, GABRB3)
- 三种γ亚基(GABRG1, GABRG2, GABRG3)
- 一种δ亚基 (GABRD)
- 一种ε亚基(GABRE)
- 一种π亚基(GABRP)
- 一种θ亚基(GABRQ)
还有三种ρ亚基(GABRR1, GABRR2, GABRR3),但ρ亚基并不与上述的其他亚基结合,而是形成GABA-ρ受体的同寡聚体(曾被认为是GABAC受体)。 五个亚基会以不同的组合形成GABAA受体。形成GABA门控离子通道的要求是至少有一个α 亚基和一个β亚基[17],而大脑中GABAA受体最常见的构成是两个α亚基,两个β亚基和一个γ亚基形成的五聚体(α2β2γ)[16]。
而两个GABA分别结合在GABAA受体的两个位点上[18],GABA位点位于α亚基和β亚基之间[16]。
配体
科学发现除GABA以外,一系列的配体都能够与GABAA受体结合,并能对该受体产生产生调节作用。
类型
- 激动剂:结合于受体的主要位点(通常结合GABA的位点,也被称作主动位点或者正构位点)并能激活受体,引起氯离子通过量增加。
- 拮抗剂:结合于受体的主要位点但并不激活受体。尽管拮抗剂本身没有作用,但它能与GABA竞争性的结合受体,并能引起受体作用抑制,以此减少氯离子通过量。
- 异构激动剂:结合于受体复合物的异构位点并能正向激动受体功能,引起主要位点的效能增加,并对氯离子通过量产生间接增效作用。
- 异构拮抗剂:结合于受体复合物的异构位点并能负向拮抗受体功能,引起主要位点的效能减少,并对氯离子通过量产生间接减效作用。
- 非竞争性拮抗剂:结合受体或者接近受体中央通道,直接引起氯离子在离子通道的通行阻滞。
典型药物
- 激动剂:GABA、加波沙朵、 鹅膏蕈氨酸、蝇蕈醇、普罗加比
- 拮抗剂:荷包牡丹碱
- 异构激动剂: 巴比妥类药物、苯二氮䓬类药物、卡立普多、乙醇、依托咪酯、格鲁米特、卡瓦内酯、[19] 甲丙氨脂、甲喹酮、神经甾体、[20] 烟酸/烟酰胺、非苯二氮䓬类药物、异丙酚、司替戊醇、[21] 茶氨酸、缬草烯酸、吸入性麻醉剂、镧[22]
- 异构拮抗剂:氟马西尼、GABA受体A拮抗剂、Ro15-4513、沙马西尼锌[23]
- 非竞争性拮抗剂:毒芹素、水芹毒素、戊四氮、印防己毒素、侧柏酮、γ-六氯环己烷
药效
能够激动GABAA受体的配体通常能够产生抗焦虑,抗惊厥,失忆症,镇静,催眠,欣快以及肌肉松弛等效果。某些药物,比如蝇蕈醇,也能够引发幻觉。而能够阻滞GABAA受体活性的配体则能产生相反的效果,比如产生焦虑及痉挛等。当前研究集中于某些亚基选择性异构拮抗剂当中,比如α5IA等,因为这些药物可产生益智效果,并能缓解GABA能药物产生的副作用[24]。
新型药物
许多苯二氮䓬类位点异构调节剂都有一种重要的性质,即它们能够选择性地结合某些特别的受体,这些受体由特定的亚基构成。这种性质可以用来检测哪种GABAA受体的亚基组合在脑的特定区域的表达占优势,同时也提供了GABAA受体的亚基组合调节行为的证据,因为不同的药物对GABAA受体的调控产生特定的生理表现。这些选择性的配体有良好的药理学特性,因为这些配体能够产生需要的治疗效果,但却不产生严重的副作用[25]。除了对α1亚基有一定选择性的药物唑吡坦以外,几乎没有其他亚基选择性配体进入临床使用,但不少亚基选择性化合物正在开发过程当中,比如α3选择性药物Adipiplon。许多亚基选择性化合物在科学研究中广泛应用,其中包括:
- CL-218,872:α1亚基高度选择性激动剂
- 溴他西尼:亚基选择性部分激动剂
- imidazenil和L-838,417:对于某些亚基类型是部分激动剂,对于其他亚基类型是弱拮抗剂
- QH-ii-066:α5亚基高度选择性完全激动剂
- α5IA:α5 亚基选择性反向激动剂
- SL-651,498:对于α2和α3亚基是完全激动剂,对于α1和α5亚基是部分激动剂
- 3-酰基-4-喹诺酮: 选择性α1亚基高于α3亚基[26]
分布
由于GABAA负责调控大部分在中枢神经中的由GABA激活的生理活动,亚基在脑中的许多组织中都有表达。亚基在不同区域有着不同的组成,而GABAA受体的不同亚型也产生了特异的功能。另外,GABAA受体也会存在于其他组织当中,这些组织包括间质细胞,胎盘,免疫细胞,肝脏,骺板及某些内分泌组织。亚基在正常细胞和恶性肿瘤细胞的表达迥异。GABAA受体能够影响细胞增殖过程[27]。
相关条目
参考文献
- ↑ Noebels JL, Avoli M, Rogawski MA, Olsen RW, Delgado-Escueta AV. Jasper's Basic Mechanisms of the Epilepsies, 4th edition. Oxford University Press. June 29, 2012. ISBN 0199746540 (英语).
- ↑ Santhakumar V, Wallner M, Otis TS. [http//www.ncbi.nlm.nih.gov/pmc/articles/PMC2040048/ Ethanol acts directly on extrasynaptic subtypes of GABAA receptors to increase tonic inhibition]. Alcohol. May 2007, 41 (3): 211–21. doi:10.1016/j.alcohol.2007.04.011. PMID 17591544. PMC 2040048.
- ↑ Johnston GAR. GABAA Receptor Pharmacology. Pharmacology and Therapeutics. 1996, 69 (3): 173–198. doi:10.1016/0163-7258(95)02043-8. PMID 8783370.
- ↑ Judith E. Tintinalli, J. Stephan Stapczynski, David M. Cline, O. John Ma, Rita K. Cydulka, Garth D. Meckler. Emergency Medicine: A Comprehensive Study Guide 6th edition. New York: McGraw-Hill. 10/14/2003. ISBN 0071388753 (英语).
- ↑ Sigel E. Mapping of the benzodiazepine recognition site on GABAA receptors. Curr Top Med Chem. August 2002, 2 (8): 833–9. doi:10.2174/1568026023393444. PMID 12171574.
- ↑ Akabas MH. GABAA receptor structure-function studies: a reexamination in light of new acetylcholine receptor structures. Int. Rev. Neurobiol.. International Review of Neurobiology. 2004, 62: 1–43. doi:10.1016/S0074-7742(04)62001-0. ISBN 978-0-12-366862-2. PMID 15530567.
- ↑ Derry JM, Dunn SM, Davies M. Identification of a residue in the gamma-aminobutyric acid type A receptor alpha subunit that differentially affects diazepam-sensitive and -insensitive benzodiazepine site binding. J. Neurochem.. March 2004, 88 (6): 1431–8. doi:10.1046/j.1471-4159.2003.02264.x. PMID 15009644.
- ↑ Barnard EA, Skolnick P, Olsen RW, Mohler H, Sieghart W, Biggio G, Braestrup C, Bateson AN, Langer SZ. International Union of Pharmacology. XV. Subtypes of gamma-aminobutyric acidA receptors: classification on the basis of subunit structure and receptor function. Pharmacol. Rev.. 1 June 1998, 50 (2): 291–313. PMID 9647870.[-{zh:失效连结;zh-tw:失效连结;zh-cn:失效链接}-]
- ↑ Atack, JR. Anxioselective compounds acting at the GABA(A) receptor benzodiazepine binding site. Current drug targets. CNS and neurological disorders. 2003, 2 (4): 213–32. doi:10.2174/1568007033482841. PMID 12871032.
- ↑ Hanson SM, Czajkowski C. [http//www.ncbi.nlm.nih.gov/pmc/articles/PMC2410040/ Structural mechanisms underlying benzodiazepine modulation of the GABAA receptor]. J. Neurosci.. March 2008, 28 (13): 3490–9. doi:10.1523/JNEUROSCI.5727-07.2008. PMID 18367615. PMC 2410040.
- ↑ Twyman RE, Rogers CJ, Macdonald RL. Differential regulation of gamma-aminobutyric acid receptor channels by diazepam and phenobarbital. Ann. Neurol.. March 1989, 25 (3): 213–20. doi:10.1002/ana.410250302. PMID 2471436.
- ↑ Wei W, Zhang N, Peng Z, Houser CR, Mody I. Perisynaptic localization of delta subunit-containing GABA(A) receptors and their activation by GABA spillover in the mouse dentate gyrus. J. Neurosci.. November 2003, 23 (33): 10650–61. PMID 14627650.
- ↑ Olsen RW, DeLorey TM. Chapter 16: GABA and Glycine//Siegel GJ, Agranoff BW, Fisher SK, Albers RW, Uhler MD. Basic neurochemistry: molecular, cellular, and medical aspects. Sixth. Philadelphia: Lippincott-Raven. 1999. ISBN 0-397-51820-X.
- ↑ Chen K, Li HZ, Ye N, Zhang J, Wang JJ. Role of GABAB receptors in GABA and baclofen-induced inhibition of adult rat cerebellar interpositus nucleus neurons in vitro. Brain Res Bull. 2005, 67 (4): 310–8. doi:10.1016/j.brainresbull.2005.07.004. PMID 16182939.
- ↑ Cossart R, Bernard C, Ben-Ari Y. Multiple facets of GABAergic neurons and synapses: multiple fates of GABA signalling in epilepsies. Trends Neurosci. 2005, 28 (2): 108–15. doi:10.1016/j.tins.2004.11.011. PMID 15667934.
- ↑ 16.0 16.1 16.2 Martin IL and Dunn SMJ. GABA receptors A review of GABA and the receptors to which it binds. Tocris Cookson LTD.
- ↑ Connolly CN, Krishek BJ, McDonald B, Smart TG, Moss SJ. Assembly and cell surface expression of heteromeric and homomeric g-aminobutyric acid type A receptors. J Biol Chem. 1996, 271 (1): 89–96. doi:10.1074/jbc.271.1.89. PMID 8550630.
- ↑ Colquhoun D, Sivilotti LG. Function and structure in glycine receptors and some of their relatives. Trends Neurosci. 2004, 27 (6): 337–44. doi:10.1016/j.tins.2004.04.010. PMID 15165738.
- ↑ Hunter, A. Kava (Piper methysticum) back in circulation. Australian Centre for Complementary Medicine. 2006, 25 (7): 529.
- ↑ (a) Herd MB, Belelli D, Lambert JJ. Neurosteroid modulation of synaptic and extrasynaptic GABAA receptors. Pharmacology & Therapeutics. 2007, 116 (1): 20–34. doi:10.1016/j.pharmthera.2007.03.007. PMID 17531325.; (b) Hosie AM, Wilkins ME, da Silva HM, Smart TG. Endogenous neurosteroids regulate GABAA receptors through two discrete transmembrane sites. Nature. 2006, 444 (7118): 486–9. doi:10.1038/nature05324. PMID 17108970.; (c)Agís-Balboa RC, Pinna G, Zhubi A, Maloku E, Veldic M, Costa E, Guidotti A. [http//www.ncbi.nlm.nih.gov/pmc/articles/PMC1600006/ Characterization of brain neurons that express enzymes mediating neurosteroid biosynthesis]. Proc. Natl. Acad. Sci. U.S.A.. 2006, 103 (39): 14602–7. doi:10.1073/pnas.0606544103. PMID 16984997. PMC 1600006.; (d) Akk G, Shu HJ, Wang C, Steinbach JH, Zorumski CF, Covey DF, Mennerick S. Neurosteroid access to the GABAA receptor. J. Neurosci.. 2005, 25 (50): 11605–13. doi:10.1523/JNEUROSCI.4173-05.2005. PMID 16354918.; (e) Belelli D, Lambert JJ. Neurosteroids: endogenous regulators of the GABAA receptor. Nat. Rev. Neurosci.. 2005, 6 (7): 565–75. doi:10.1038/nrn1703. PMID 15959466.; (f) Pinna G, Costa E, Guidotti A. Fluoxetine and norfluoxetine stereospecifically and selectively increase brain neurosteroid content at doses that are inactive on 5-HT reuptake. Psychopharmacology (Berl.). 2006, 186 (3): 362–72. doi:10.1007/s00213-005-0213-2. PMID 16432684.; (g) Dubrovsky BO. Steroids, neuroactive steroids and neurosteroids in psychopathology. Prog. Neuropsychopharmacol. Biol. Psychiatry. 2005, 29 (2): 169–92. doi:10.1016/j.pnpbp.2004.11.001. PMID 15694225.; (h) Mellon SH, Griffin LD. Neurosteroids: biochemistry and clinical significance. Trends Endocrinol. Metab.. 2002, 13 (1): 35–43. doi:10.1016/S1043-2760(01)00503-3. PMID 11750861.; (i) Puia G, Santi MR, Vicini S, Pritchett DB, Purdy RH, Paul SM, Seeburg PH, Costa E. Neurosteroids act on recombinant human GABAA receptors. Neuron. 1990, 4 (5): 759–65. doi:10.1016/0896-6273(90)90202-Q. PMID 2160838.; (j) Majewska MD, Harrison NL, Schwartz RD, Barker JL, Paul SM. Steroid hormone metabolites are barbiturate-like modulators of the GABA receptor. Science. 1986, 232 (4753): 1004–7. doi:10.1126/science.2422758. PMID 2422758.
- ↑ Fisher JL. [http//www.ncbi.nlm.nih.gov/pmc/articles/PMC2665930/ The anti-convulsant stiripentol acts directly on the GABA(A) receptor as a positive allosteric modulator]. Neuropharmacology. 2009, 56 (1): 190–7. doi:10.1016/j.neuropharm.2008.06.004. PMID 18585399. PMC 2665930.
- ↑ Boldyreva, A. A.. Lanthanum Potentiates GABA-Activated Currents in Rat Pyramidal Neurons of CA1 Hippocampal Field. Bulletin of Experimental Biology and Medicine. 2005, 140 (4): 403–5. doi:10.1007/s10517-005-0503-z. PMID 16671565.
- ↑ Hosie AM,Dunne EL,Harvey RJ,Smart TG. Zinc-mediated inhibition of GABA(A) receptors: discrete binding sites underlie subtype specificity. Nat Neurosci.. 2003, 6: 362–9. PMID 12640458.
- ↑ Dawson GR, Maubach KA, Collinson N, Cobain M, Everitt BJ, MacLeod AM, Choudhury HI, McDonald LM, Pillai G, Rycroft W, Smith AJ, Sternfeld F, Tattersall FD, Wafford KA, Reynolds DS, Seabrook GR, Atack JR. An inverse agonist selective for alpha5 subunit-containing GABAA receptors enhances cognition. J. Pharmacol. Exp. Ther.. March 2006, 316 (3): 1335–45. doi:10.1124/jpet.105.092320. PMID 16326923.
- ↑ Da Settimo F, Taliani S, Trincavelli ML, Montali M, Martini C. GABA A/Bz receptor subtypes as targets for selective drugs. Curr. Med. Chem.. 2007, 14 (25): 2680–701. doi:10.2174/092986707782023190. PMID 17979718.
- ↑ Lager E, Nilsson J, Østergaard Nielsen E, Nielsen M, Liljefors T, Sterner O. Affinity of 3-acyl substituted 4-quinolones at the benzodiazepine site of GABAA receptors. Bioorg. Med. Chem.. July 2008, 16 (14): 6936–48. doi:10.1016/j.bmc.2008.05.049. PMID 18541432.
- ↑ ten Hoeve AL (2012). GABA receptors and the immune system. Thesis, Utrecht University
外部链接
- MeSH(医学主题词)上面的Receptors,+GABA-A
- Olsen RW, DeLorey TM. Chapter 16: GABA and Glycine//Siegel GJ, Agranoff BW, Fisher SK, Albers RW, Uhler MD. Basic neurochemistry: molecular, cellular, and medical aspects. Sixth. Philadelphia: Lippincott-Raven. 1999. ISBN 0-397-51820-X.
- Olsen RW, Betz H. Chapter 16: GABA and Glycine//Siegel GJ, Albers RW, Brady S , Price DD. Basic Neurochemistry: Molecular, Cellular and Medical Aspects. Seventh. Boston: Academic Press. 2005: pp. 291–302. ISBN 0-12-088397-X.
|
||||||||||||||||||||||||||||||||||||||
参考来源
| 关于“Γ-氨基丁酸A型受体”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |