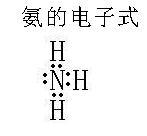氨
| A+医学百科 >> 氨 |
氨(Ammonia,即阿摩尼亚),或称“氨气”,分子式为NH3,是一种无色气体,有强烈的刺激气味。极易溶于水,常温常压下1体积水可溶解700倍体积氨。氨对地球上的生物相当重要,它是所有食物和肥料的重要成分。氨也是所有药物直接或间接的组成。氨有很广泛的用途,同时它还具有腐蚀性等危险性质。由于氨有广泛的用途,氨是世界上产量最多的无机化合物之一,多于八成的氨被用于制作化肥。由于氨可以提供孤对电子,所以它也是一种路易斯碱。
目录 |
简介
化学式:NH3
电子式:如右图
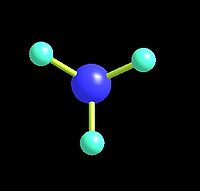
一、结构:氨分子为三角锥形分子,是极性分子。N原子以sp3杂化轨道成键。
二、物理性质:氨气通常情况下是有刺激性气味的无色气体,密度比空气小,极易溶于水,易液化,液氨可作制冷剂。以700:1的溶解度溶于水。
摩尔质量:17.0306 CAS: 7664-41-7 密度:0.6942
熔点:-77.73 °C 沸点:-33.34 °C
在水中溶解度:89.9 g/100 mL, 0 °C
偶极距:1.42 D
主要化学性质
1、NH3遇HCl气体有白烟产生,可与氯气反应。
2、氨水(混称氢氧化铵,NH4OH)可腐蚀许多金属,一般若用铁桶装氨水,铁桶应内涂沥青。
3、氨的催化氧化是放热反应,产物是NO,是工业制硝酸的重要反应,NH3也可以被氧化成N2。
在水中产生少量氢氧根离子,是弱碱.
主要用途
NH3用于制氨水、液氨、氮肥(尿素、碳铵等)、HNO3、铵盐、纯碱,广泛应用于化工、轻工、化肥、制药、合成纤维、塑料、染料等。
制法
1.合成氨的工艺流程
(1)原料气制备 将煤和天然气等原料制成含氢和氮的粗原料气。对于固体原料煤和焦炭,通常采用气化的方法制取合成气;渣油可采用非催化部分氧化的方法获得合成气;对气态烃类和石脑油,工业中利用二段蒸汽转化法制取合成气。
(2)净化 对粗原料气进行净化处理,除去氢气和氮气以外的杂质,主要包括变换过程、脱硫脱碳过程以及气体精制过程。
① 一氧化碳变换过程
在合成氨生产中,各种方法制取的原料气都含有CO,其体积分数一般为12%~40%。合成氨需要的两种组分是H2和N2,因此需要除去合成气中的CO。变换反应如下:
CO+H2O→H2+CO2 ΔH =-41.2kJ/mol
由于CO变换过程是强放热过程,必须分段进行以利于回收反应热,并控制变换段出口残余CO含量。第一步是高温变换,使大部分CO转变为CO2和H2;第二步是低温变换,将CO含量降至0.3%左右。因此,CO变换反应既是原料气制造的继续,又是净化的过程,为后续脱碳过程创造条件。
② 脱硫脱碳过程
各种原料制取的粗原料气,都含有一些硫和碳的氧化物,为了防止合成氨生产过程催化剂的中毒,必须在氨合成工序前加以脱除,以天然气为原料的蒸汽转化法,第一道工序是脱硫,用以保护转化催化剂,以重油和煤为原料的部分氧化法,根据一氧化碳变换是否采用耐硫的催化剂而确定脱硫的位置。工业脱硫方法种类很多,通常是采用物理或化学吸收的方法,常用的有低温甲醇洗法(Rectisol)、聚乙二醇二甲醚法(Selexol)等。
粗原料气经CO变换以后,变换气中除H2外,还有CO2、CO和CH4等组分,其中以CO2含量最多。CO2既是氨合成催化剂的毒物,又是制造尿素、碳酸氢铵等氮肥的重要原料。因此变换气中CO2的脱除必须兼顾这两方面的要求。
一般采用溶液吸收法脱除CO2。根据吸收剂性能的不同,可分为两大类。一类是物理吸收法,如低温甲醇洗法(Rectisol),聚乙二醇二甲醚法(Selexol),碳酸丙烯酯法。一类是化学吸收法,如热钾碱法,低热耗本菲尔法,活化MDEA法,MEA法等。 4
③ 气体精制过程
经CO变换和CO2脱除后的原料气中尚含有少量残余的CO和CO2。为了防止对氨合成催化剂的毒害,规定CO和CO2总含量不得大于10cm3/m3(体积分数)。因此,原料气在进入合成工序前,必须进行原料气的最终净化,即精制过程。
目前在工业生产中,最终净化方法分为深冷分离法和甲烷化法。深冷分离法主要是液氮洗法,是在深度冷冻(<-100℃)条件下用液氮吸收分离少量CO,而且也能脱除甲烷和大部分氩,这样可以获得只含有惰性气体100cm3/m3以下的氢氮混合气,深冷净化法通常与空分以及低温甲醇洗结合。甲烷化法是在催化剂存在下使少量CO、CO2与H2反应生成CH4和H2O的一种净化工艺,要求入口原料气中碳的氧化物含量(体积分数)一般应小于0.7%。甲烷化法可以将气体中碳的氧化物(CO+CO2)含量脱除到10cm3/m3以下,但是需要消耗有效成分H2,并且增加了惰性气体CH4的含量。甲烷化反应如下:
CO+3H2→CH4+H2O ΔH=-206.2kJ/mol
CO2+4H2→CH4+2H2O ΔH=-165.1kJ/mol
(3)氨合成 将纯净的氢、氮混合气压缩到高压,在催化剂的作用下合成氨。氨的合成是提供液氨产品的工序,是整个合成氨生产过程的核心部分。氨合成反应在较高压力和催化剂存在的条件下进行,由于反应后气体中氨含量不高,一般只有10%~20%,故采用未反应氢氮气循环的流程。氨合成反应式如下:
N2+3H2→2NH3(g) ΔH=-92.4kJ/mol
2.合成氨的催化机理
热力学计算表明,低温、高压对合成氨反应是有利的,但无催化剂时,反应的活化能很高,反应几乎不发生。当采用铁催化剂时,由于改变了反应历程,降低了反应的活化能,使反应以显著的速率进行。目前认为,合成氨反应的一种可能机理,首先是氮分子在铁催化剂表面上进行化学吸附,使氮原子间的化学键减弱。接着是化学吸附的氢原子不断地跟表面上的氮分子作用,在催化剂表面上逐步生成—NH、—NH2和NH3,最后氨分子在表面上脱吸而生成气态的氨。上述反应途径可简单地表示为:
xFe + N2→FexN
FexN +〔H〕吸→FexNH
FexNH +〔H〕吸→FexNH2
FexNH2 +〔H〕吸FexNH3→xFe+NH3
在无催化剂时,氨的合成反应的活化能很高,大约335 kJ/mol。加入铁催化剂后,反应以生成氮化物和氮氢化物两个阶段进行。第一阶段的反应活化能为126 kJ/mol~167 kJ/mol,第二阶段的反应活化能为13 kJ/mol。由于反应途径的改变(生成不稳定的中间化合物),降低了反应的活化能,因而反应速率加快了。
3.催化剂的中毒
催化剂的催化能力一般称为催化活性。有人认为:由于催化剂在反应前后的化学性质和质量不变,一旦制成一批催化剂之后,便可以永远使用下去。实际上许多催化剂在使用过程中,其活性从小到大,逐渐达到正常水平,这就是催化剂的成熟期。接着,催化剂活性在一段时间里保持稳定,然后再下降,一直到衰老而不能再使用。活性保持稳定的时间即为催化剂的寿命,其长短因催化剂的制备方法和使用条件而异。
催化剂在稳定活性期间,往往因接触少量的杂质而使活性明显下降甚至被破坏,这种现象称为催化剂的中毒。一般认为是由于催化剂表面的活性中心被杂质占据而引起中毒。中毒分为暂时性中毒和永久性中毒两种。例如,对于合成氨反应中的铁催化剂,O2、CO、CO2和水蒸气等都能使催化剂中毒。但利用纯净的氢、氮混合气体通过中毒的催化剂时,催化剂的活性又能恢复,因此这种中毒是暂时性中毒。相反,含P、S、As的化合物则可使铁催化剂永久性中毒。催化剂中毒后,往往完全失去活性,这时即使再用纯净的氢、氮混合气体处理,活性也很难恢复。催化剂中毒会严重影响生产的正常进行。工业上为了防止催化剂中毒,要把反应物原料加以净化,以除去毒物,这样就要增加设备,提高成本。因此,研制具有较强抗毒能力的新型催化剂,是一个重要的课题。
4.我国合成氨工业的发展情况
解放前我国只有两家规模不大的合成氨厂,解放后合成氨工业有了迅速发展。1949年全国氮肥产量仅0.6万吨,而1982年达到1021.9万吨,成为世界上产量最高的国家之一。
近几年来,我国引进了一批年产30万吨氮肥的大型化肥厂设备。我国自行设计和建造的上海吴泾化工厂也是年产30万吨氮肥的大型化肥厂。这些化肥厂以天然气、石油、炼油气等为原料,生产中能量损耗低、产量高,技术和设备都很先进。
5.化学模拟生物固氮的研究
目前,化学模拟生物固氮的重要研究课题之一,是固氮酶活性中心结构的研究。固氮酶由铁蛋白和钼铁蛋白这两种含过渡金属的蛋白质组合而成。铁蛋白主要起着电子传递输送的作用,而含二个钼原子和二三十个铁和硫原子的钼铁蛋白是络合N2或其他反应物(底物)分子,并进行反应的活性中心所在之处。关于活性中心的结构有多种看法,目前尚无定论。从各种底物结合物活化和还原加氢试验来看,含双钼核的活性中心较为合理。我国有两个研究组于1973—1974年间,不约而同地提出了含钼铁的三核、四核活性中心模型,能较好地解释固氮酶的一系列性能,但其结构细节还有待根据新的实验结果精确化。
国际上有关的研究成果认为,温和条件下的固氮作用一般包含以下三个环节:
①络合过程。它是用某些过渡金属的有机络合物去络合N2,使它的化学键削弱;②还原过程。它是用化学还原剂或其他还原方法输送电子给被络合的N2,来拆开N2中的N-N键;③加氢过程。它是提供H+来和负价的N结合,生成NH3。
目前,化学模拟生物固氮工作的一个主要困难是,N2络合了但基本上没有活化,或络合活化了,但活化得很不够。所以,稳定的双氮基络合物一般在温和条件下通过化学还原剂的作用只能析出N2,从不稳定的双氮络合物还原制出的NH3的量相当微少。因此迫切需要从理论上深入分析,以便找出突破的途径。
固氮酶的生物化学和化学模拟工作已取得一定的进展,这必将有力地推动络合催化的研究,特别是对寻找催化效率高的合成氨催化剂,将是一个有力的促进。
氨
药物名称
氨
简介
化学式:NH3
药物别名: 暂无
英文名称: Ammonia
药物说明: 稀氨溶液〔典〕(Dilute Ammonia Solution):每100ml中含氨10g,为无色的澄清液体;有刺激性特臭,呈碱性反应。对昏迷、麻醉不醒者,嗅入本品有催醒作用。亦用于手术前医生手的消毒,每次用本品25ml,加温开水5L稀释后供用。
主要成分: 暂无
性状特征: 暂无
功能主治: 吸入或口服本品,可刺激呼吸道或胃粘膜,反射性兴奋呼吸和循环中枢。昏迷、醉酒者吸入氨水有苏醒作用,对昏厥者作用较好。外用配成25%搽剂作为刺激药,尚有中和酸的作用,用于昆虫咬伤等。
用法用量: 暂无
不良反应: 暂无
注意事项: 暂无
卫生标准
MAC(NH3)=30mg/m3 , 44.11ppm;
STEL(NH3)=35ppm
IDLH(NH3)=300PPM
ERPG 浓度(ppm) 危害
ERPG1 25 引起刺激作用
ERPG2 200 可引起永久性损伤
ERPG3 1000 可致死
1,血氨增高原因
血氨清除不足 肝内鸟氨酸循环合成尿素是机体清除氨的主要代谢途径。当供给鸟氨酸循环的ATP不足,催化鸟氨酸循环的有关酶的活性降低,其循环所需底物严重缺乏,以及肠道吸收的氨经门—体分流直接进入循环等多个环节2作用,最终导致血氨的增高。
血氨生成增多 1.肠道产氨增多 肝病致吸收不良,血液循环不畅、胆汁水泌不够,食物消化不良致大量细菌繁殖增生,作用于肠道积聚的蛋白质及尿素,使产氨明显增多。2.肾衰致血液中的尿素等非蛋白氮含量高于正常,因而弥散至肠腔内的尿素大大增加,使产氨增多。3.烦躁不安、震颤等肌肉活动增强,使肌肉中的腺苷酸分解代谢增强,也是血氨产生增多的原因之一。
肠道PH降低\尿液PH值升高 尿液中PH升高,则进入肾小管腔的NH3与H+结合减少,则NH3以氨根离子的形式随尿排出的形式减少,致血氨升高。 肠道PH降低,氨根离子易于H+结合生成NH3,而不易随粪便排出,使其吸收增加,致血氨浓度升高。
2,氨中毒机理
1.氨能够干扰脑细胞的能量代谢 氨抑制丙酮酸脱羧酶的活性,使乙酰CoA生成减少,影响三羧酸循环的正常进行;消耗大量
α-酮戊二酸和还原型辅酶Ι ,造成ATP生成不足;氨与谷氨酸结合生成谷氨酰胺的过程中大量消耗ATP。总之,氨耗大是ATP,又使得脑细胞ATP生成减少以抑制脑细胞。
2.脑内神经递质的改变 氨引起脑内谷氨酸、Ach等兴奋神经递质的减少,又使谷氨酰胺、γ-氨基丁酸等抑制性神经递质增多,从而造成对中枢神经系统的抑制。
3.对神经细胞的抑制作用 NH3干扰神经细胞膜上的Na- K-ATP酶,使复极后膜离子转动障碍,导致膜电位改变和兴奋性异常;NH3与K+有竞争作用,影响Na K 在神经的细胞膜上的正常分布,从而干扰神经传导活动。
综上,氨中毒主要抑制中枢神经系统,正常情况下,中枢神经系统能够抑制外周的低级中枢,当中枢神经系统受抑制,使得其对外周低级中枢的抑制作用减弱甚至消失,从而外周低级中枢兴奋,出现一系列如肌随意性兴奋、角弓反射及抽搐等本能反应。
| 关于“氨”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |