病理学/坏死
| 医学电子书 >> 《病理学》 >> 细胞和组织的损伤 >> 损伤 >> 坏死 |
| 病理学 |
|
|
生活机体的局部组织、细胞死亡后出现的形态学改变称为坏死(necrosis)。坏死组织、细胞的代谢停止,功能丧失,出现一系列特征性的形态学改 变。坏死的原因多种多样,举凡一切损伤因子,只要其作用达到一定的强度或持续一定的时间,从而使受损组织、细胞的代谢完全停止时,即引起组织、细胞的死亡 (坏死)。在多数情况下,坏死是由组织、细胞的变性逐渐发展而来的,即渐进性坏死(necrobiosis)。在此期间,只要坏死尚未发生而病因被消除, 则组织、细胞的损伤仍可能恢复(可复期)。但一旦组织、细胞的损伤严重,代谢紊乱,出现一系列坏死的形态学改变时,则损伤不再能恢复(不可复期)。
在个别情况下,由于致病因子极为强烈,坏死可迅速发生,有时甚至无明显的形态学改变。例如将生活中的组织、细胞立即投入甲醛溶液中固定时,细胞迅即死亡,但形态上则保持完好。故单纯从形态上有时难以判断细胞是否死亡。
由 于损伤因子的性质不同,引起细胞死亡的途径也各异:X线引起DNA螺旋的断裂,导致细胞核信息中心的损害;CCl4通过过氧化物阻断核蛋白合成的翻译过 程;缺血阻断线粒体的呼吸链;维生素A中毒使溶酶体酶外逸。因而,根据不同的损伤类型,某种细胞器的病变乃居于主要地位。
(一)坏死的病变
细胞坏死过程中的可复性改变与不可复性改变之间并无截然的界限,只有在损伤的后期,当出现明显的形态学改变时,才能在电子显微镜下判断细胞业已死亡。而在光学显微镜下,通常要在细胞死亡后若干小时之后,当自溶性改变相当明显时才能加以辨别。
1. 细胞核的改变 细胞核的改变是细胞坏死的主要形态学标志,表现为:①核浓缩(pyknosis),即由于核脱水使染色质浓缩,染色变深,核的体积缩小;②核碎裂 (karyorrhexis),核染色质崩解为小碎片,核膜破裂,染色质碎片分散在胞浆中;③核溶解(karyolysis),在脱氧核糖核酸酶的作用 下,染色质的DNA分解,核乃失去对碱性染料的亲和力,因而染色质变淡,甚至只能见到核的轮廓。往后染色质中残余的蛋白质被溶蛋白酶所溶解,核便完全消失 (图1-23)。这一状态约经10小时才能达到正常细胞核浓缩核碎裂核溶解消失
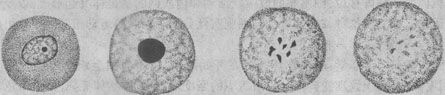
图1-23 细胞坏死时核的变化模式图
坏 死细胞核的上述变化过程可因损伤因子作用的强弱和发展过程的快慢而有所不同。损伤因子的作用较弱、病变经过缓慢时(如缺血栓梗死),上述核的改变可顺序发 生,即先出现核浓缩,然后碎裂,最后核溶解;但如损伤因子作用强烈,经过急剧(如中毒),则往往先发生染色质边集,继即进入核碎裂,甚或可从正常核迅即发 生核溶解。
2.细胞浆的改变 坏死细胞的胞浆红染(即嗜酸性),这是由于胞浆嗜硷性物质核蛋白体减少或丧失,使胞浆与硷性染料苏木素的结合减少而与酸性染料伊红的结合力增高的缘故。同 时由于胞浆结构崩解,致胞浆呈颗粒状。有时由于实质细胞坏死后,整个细胞迅速溶解、吸收而消失(溶解性坏死)。有时单个实质细胞(如肝细胞)坏死后,胞浆 内水分逐渐丧失,核浓缩而后消失,胞体固缩,胞浆呈强酸性染色(红染),形成所谓嗜酸性小体,称为嗜酸性坏死或固缩坏死。
3.间质的改变实质细胞坏死后一段时间内,间质常无改变。以后在各种溶解酶的作用下,基质崩解,胶原纤维肿胀并崩解断裂或液化。于是坏死的细胞和崩解的间质融合成一片模糊的颗粒状、无结构的红染物质。
上 述坏死的形态学改变通常要在组织、细胞死亡后相当时间(数小时至10小时以上)才出现。在坏死的早期阶段,不仅肉眼观难以鉴别,甚至在电子显微镜下也不能 确定该组织、细胞是否死亡。临床上将这种已失去生活能力的组织称为失活组织。这种组织已不能复活,但却是细菌生长繁殖的良好基地。为防止感染,促进愈合, 在治疗中常需将其清除。
(二)坏死的类型
形态学上可将坏死分为以下类型:
1. 局灶性胞浆坏死 并非任何致死性的细胞损伤均必然导致整个细胞的坏死。有时坏死仅局限于细胞的某一部位,称为局灶性胞浆坏死。这种坏死区由界膜加以包裹,从而与周围健康胞 浆相隔离。这样,各种水解酶就可经内质网系统进入其中,将坏死结构加以溶解消化,而不致损伤细胞的其余部分。
2.凝固性坏死 坏死组织由于失水变干、蛋白质凝固而变成灰白或黄白色比较坚实的凝固体,故称凝固性坏死(coagulation necrosis)。特点是坏死组织的水分减少,而结构轮廓则依然较长时间地保存。
凝 固性坏死的发生机制仍不甚清楚。Weigert认为是胞浆凝固的结果,因为溶酶体酶在此不起重要作用,这是由于或则组织所含溶酶体较少,或则溶酶体酶在某 种程序上也受到了损伤的缘故。但在细胞僵死以前,在生体显微镜下可见到胞浆内的运动过程加强,表现为线粒体的一阵阵移位、细胞膜的波浪状活动和内质网的伪 足样突起形成,以及细胞核的旋转运动。细胞的这种临终期运动与细胞有丝分裂开始时的运动相同。因此可以说细胞的死亡与新生的过程是相似的。
凝 固性坏死的形态学:凝固性坏死灶在开始阶段,由于周围组织液的进入而明显肿胀,透明度降低,组织纹理变模糊。尔后组织的坚度逐渐增加,状如煮熟,呈土黄 色。这些改变最早要在细胞死亡开始后6~8小时以后才能见到。坏死灶的周围形成一暗红色缘(出血边带)与健康组织分界。镜下,在较早期可见坏死组织的细胞 结构消失,但组织结构的轮廓依然保存。例如肾的贫血性梗死初期,虽然细胞已呈坏死改变,但肾小球、肾小管以及血管等的轮廓仍可辨认。脾的贫血性梗死也是如 此。
凝固性坏死的特殊类型:
(1)干酪样坏死(caseous necrosis, caseation):主要见于结核杆菌引起的坏死,如结核病灶的坏死。这时坏死组织彻底崩解,镜下不见组织轮廓,只见一些无定形的颗粒状物质(图 1-24),同时由于坏死组织含有较多脂质(来自崩解的粒细胞和结核杆菌)故略带黄色,加之脂质又阻抑了溶酶体酶的溶蛋白作用,故结果形成了状如干酪的物 质,因而得名。

图1-24 干酪性坏死(镜下)
结核病灶中心的干酪样坏死,呈一片模糊细颗粒状无结构物质
(2) 坏疽(gangrene):坏疽为组织坏死后又发生了继发性改变的结果。当大块组织坏死后,由于发生了不同程度的腐败菌感染和其他因素的影响而呈现黑色、 污绿色等特殊形态改变,即成为坏疽。坏死组织经腐败菌分散,产生硫化氢,后者与血红蛋白中分解出来的铁相结合,乃形成黑色的硫化铁,使坏死组织呈黑色。坏 疽可分为此下3种类型:
1)干性坏疽:干性坏疽是凝固性坏死加上坏死组织的水分蒸发变干的结果,大多见于四肢末端,例如动脉粥样硬化、血栓 闭塞性脉管炎和冻伤等疾患时。此时动脉受阻而静脉仍通畅,故坏死组织的水分少,再加上在空气中蒸发,故病变部位干固皱缩,呈黑褐色,与周围健康组织之间有 明显的分界线(图1-25)。同时,由于坏死组织比较干燥,故既可防止细菌的入侵,也可阻抑坏死组织的自溶分解。因而干性坏疽的腐败菌感染一般较轻。
2) 湿性坏疽:湿性坏疽多发生于内脏(子宫、肺等),也可见于四肢(当其动脉闭塞而静脉回流又受阻,伴有淤血水肿时)。此时由于坏死组织含水分较多,适合腐败 菌生长繁殖,故腐败菌感染严重,局部明显肿胀,呈深蓝、暗绿或污黑色。腐败菌分解蛋白质,产生吲哚(indole)、粪臭素(scatole)等,造成恶 臭。由于病变发展较快,炎症比较弥漫,故坏死组织与健康组织的分界线不明显。同时组织坏死腐败所产生的毒性产物及细菌毒素被吸收后,可引起严重的全身中毒 症状。常见的湿性坏疽有坏疽性阑尾炎、肠坏疽、肺坏疽及产后坏疽性子宫内膜炎等。
3)气性坏疽:为湿性坏死的一种特殊类型,主要见于严重的深达肌肉的开放性创伤合并产气荚膜杆菌、恶生水肿杆菌及腐败弧菌等厌气菌感染时,细菌分解坏死组织时产生大量气体,使坏死组织内含气泡呈蜂窝状,按之有捻发音。气性坏疽发展迅速,毒素吸收多,后果严重,需紧急处理。
3. 液化性坏死 在液化性坏死(liquefaction necrosis)时,坏死组织起初肿胀,随即发生酶性溶解,形成软化灶。此时,坏死组织的水解占主导地位。与凝固性坏死相反,液化性坏死主要发生在含可 凝固的蛋白质少和脂质多(如脑)或产生蛋白酶多(如胰腺)的组织。凝固性坏死的组织发生细菌感染时,则白细胞的水解酶也能引起组织溶解液化(如感染的肺梗 死)。
液化性坏死时,坏死组织分解液化而呈液化,并可形成坏死腔。
脂肪坏死:脂肪坏死为液化性坏死的一种特殊类型,主要有酶 解性脂肪坏死和外伤性脂肪坏死两种。前者常见于急性胰腺炎时,此时胰腺组织受损,胰酶外逸并被激活,从而引起胰腺自身消化和胰周围及腹腔器官的脂肪组织被 胰脂酶所分解,其中的脂肪酸与组织中的钙结合形成钙皂,表现为不透明的灰白色的斑点或斑块。镜下,坏死的脂肪细胞仅留下模糊混浊的轮廓。外伤性脂肪坏死则 大多见于乳房,此时由于脂肪组织受伤而致命伤脂肪细胞破裂,脂肪外逸,并常在乳房内形成肿块,镜下可见其中含有大量吞噬脂滴的巨噬细胞(泡沫细胞)和多核 异物巨细胞。
4.固缩坏死 固缩坏大多为细胞的生理性死亡,乃细胞衰老过程中各个细胞功能逐渐息灭的结果。这种坏死通常仅表现为单个细胞坏 死或小灶状坏死,而从不见整个实质区细胞同时坏死,故可与树叶的枯萎凋谢过程(apoptosis,凋落)相比拟。固缩坏死(凋落)的发生机制与上述凝固 性或液化性坏死均不同,而是由细胞的遗传素质而决定的。根据遗传素质,各种细胞损伤性刺激可改变遗传信息的转录和(或)翻译,形成死亡蛋白,后者能激活核 酸内切酶,引起核染色质的凝集,标志着固缩性坏死的开始,不可复性的胞浆损害继之发生。
固缩坏死即凋落见于许多生理和病理过程中,为各种更替性组织中细胞衰亡更新的表现,也可见于照射及应用细胞抑制剂之后和数目性萎缩时。肿瘤细胞也能自发地发生固缩坏死。
固 缩坏死的最初形态表现为染色质沿皱缩的核膜下凝聚,细胞连接松解,微绒毛及细胞突起消失;细胞表面有一些泡状胞浆膨隆,可脱落形成凋落小体(图 1-26),后者可见于腺腔内或被周围健康细胞所吞噬(例如肝细胞内的Councilman小体);继而内质网池扩大、断裂,线粒体结构虽仍完好,但基质 呈絮状致密化。
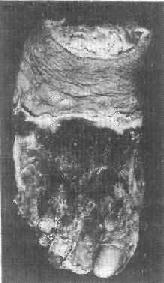
图1-25 足干性坏疽
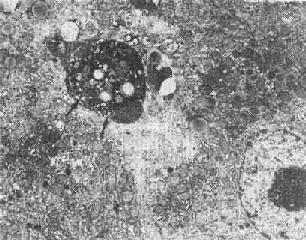
图1-26 肝细胞凋落小体(左上)
图中左上方电子致密团块(↑),其中可见脂滴及变性崩解细胞器。
其右侧为一髓鞘样结构
(三)坏死的结局
1. 溶解吸收 这是机体处理坏死组织的基本方式。来自坏死组织本身和中性粒细胞的溶蛋白酶将坏死物质进一步分解、液化,然后由淋巴管或血管加以吸收,不能吸收 的碎片则由巨噬细胞加以吞噬消化。留下的组织缺损则由细胞再生或肉芽组织形成予以修复或形成含有淡黄色液体的囊腔(如脑软化灶)。
2.分离 排出 较大坏死灶不易完全吸收,其周围发生炎性反应,其中的白细胞释放溶蛋白酶,加速坏死边缘坏死组织的溶解吸收,使坏死灶与健康组织分离。坏死灶如位于 皮肤的或粘膜,则坏死组织脱落后形成溃疡;肾、肺等内脏器官坏死组织液化后可经相应管道(输尿管、气管)排出,留下空腔,称为空洞。溃疡和空洞以后仍可修 复。
3.机化(organization) 坏死组织如不能完全溶解吸收或分离排出,则由周围组织新生毛细血管和纤维母细胞等组成肉芽组织,长入坏死,逐渐加以溶解、吸收和取代,最后成为瘢痕组织。这种由新生肉芽组织取代坏死组织(或其他异物如血栓等)的过程称为机化。
4.包裹、钙化 坏死灶如较大,或坏死物质难以溶解吸收,或不能完全机化,则常由周围新生结缔组织加以包裹(encapsulation),其中的坏死物质有时可发生钙化(calcification),如结核病灶的干酪样坏死即常发生这种改变。
参考
| 关于“病理学/坏死”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |