临床生物化学/胎盘激素
| 医学电子书 >> 《临床生物化学》 >> 妊娠的临床生物化学 >> 妊娠期的内分泌特点 >> 胎盘激素 |
| 临床生物化学 |
|
|
妊娠期胎盘能合成大量甾体激素如雌激素(雌二醇、雌酮、雌三醇)、孕激素(孕酮、孕二醇)等,此外胎盘还合成大量蛋白激素如绒毛膜促性腺激素、胎盘生乳素等。人类胎盘合成分泌的主要激素有:
人类胎盘绒毛膜促性腺激素(human chorionicgonadotropin,hCG)为蛋白,分子量约为39000u,由α-亚基与β-亚基以11-12个硫键互联而成,它在胎盘合体滋养层细胞内合成,为胎盘独有。α-亚基分子量为14900,含92个氨基酸及40%糖;β亚基则由145氨基酸组成,其分子量为23000u,含糖约30%。黄体生成素(LH)、卵泡刺激素(FSH)及促甲状腺激素(TSH)的α-亚基结构与hCG的α-亚基结构大致相同,这四种激素的区别仅在于β-亚基结构不同。胚胎着床后hCG的生成量呈对数递增,到6-8周达高峰,妊娠60-80天达到最高峰,随后逐渐下降,到妊娠160-180天时下降到最低点,此后稍又回升继续保持到分娩。妊娠早期hCG的主要功能是维持卵巢的黄体分泌孕酮以维持早期胚胎发育的需要;它在胎儿-胎盘复合体中还促进类固醇激素的生物合成。
(二)人类胎盘催乳素
人类胎盘催乳素(human placenta lactogen,hPL)也称人类绒毛膜促生长催乳素(human chorionicsomatamammotropin,hCS),为单链多肽类激素,其分子量为21600u,由190个氨基酸残基合成,含有两条链内二硫键。人胎盘催乳素与人生长激素有160个相同的氨基酸残基序列,因此二者在免疫学与生物学方面密切相关。hPL也由胎盘合体滋养层细胞合成与分泌,分泌后大部分进入绒毛间隙和胎盘血窦,很少出现于胎体内。
妊娠5-6周即可用放射免疫法测出血浆中的hPL,以后分泌量缓慢上升,自15-30周时即迅速增高,到妊娠34周时达高峰,约7.75mg/L-10.6mg/L以后维持此水平直到分娩。hPL的半寿期在21-23分钟之间,分泌量与胎盘体积成正比;足月妊娠时,每日每百克胎盘约分泌0.5g hPL,以此计算整个胎盘每日分泌1-2g 左右的hPL,产后迅速下降,3-6小时即测不出。
hPL的功能是在孕妇体内与胰岛素、皮质激素协同作用促进乳腺发育及促进正氮平衡,有利于妊娠期蛋白质的蓄积。hPL还抑制脂肪沉积作用,促进脂肪分解使血中游离脂酸升高。当血液中游离脂酸较葡萄糖占优势时,肌组织主要以游离脂酸作为能源,减少对葡萄糖的摄取,有利于胎儿从母血大量地摄取葡萄糖。hPL这一功能是胎儿迅速生长发育的重要条件。hPL在母血中含量与胎盘重量及胎儿体重相关,可直接反映胎盘的功能状态。
(三)孕酮
孕激素主要有孕酮及其代谢产物孕烷二醇,属甾体激素。孕酮由卵巢和肾上腺合成。
胎盘能利用孕母血中的胆固醇合成孕酮,从妊娠36天起它即能生产足够孕酮。非孕妇血浆孕酮值在0-15ng/ml,孕妇于妊娠第5周时血清中的浓度为24±7.3ng/ml,到孕32周时增高到125.2±37ng/ml,到37孕周达到最高峰为150ng/ml,一直保持到临产前才稍降。待胎盘娩出后迅速降至10-20ng/ml。这证明妊娠末期孕妇血清高水平的孕酮来自胎盘分泌。妊娠早期孕酮日分泌为30-50mg左右(未孕妇仅1-25mg/d),主要为妊娠黄体分泌,到孕末期分泌量为250-300mg/d。胎盘合成的孕酮大部分进入母体与胎儿并进行代谢,主要代谢产物为孕烷二醇,后者主要在肝转变成葡萄糖酸苷及硫酸酯等结合形式,结合型水溶性增加,易从尿中排出,妊娠期末期孕妇尿液中孕烷二醇日排泄量约为35-40mg。血中孕烷二醇的水平随孕酮水平而变动,尿中排泄量也与孕妇血中孕酮量成正比。胎盘内孕酮的合成过程以图14-1简示。
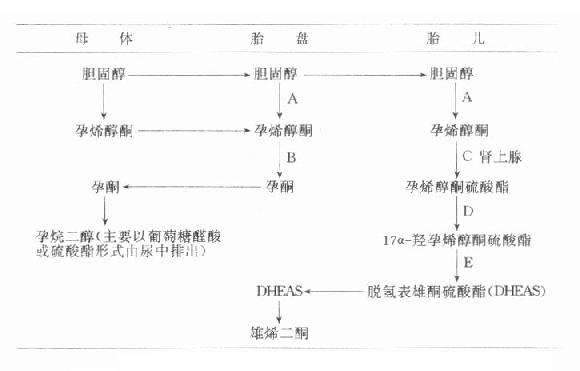
图14-1 胎儿-胎盘复合体孕酮合成途径
有关酶类:A=C20-22裂解酶;B=3β-脱氢酶;C=硫酸酯激酶;
D=17α-羟化酶;E=C17-20裂解酶
从图14-1可见,胎盘合成孕酮的原料是胆固醇,它来源于母血供应。母血还可直接输送孕酮的前身物-孕烯醇酮,用于合成孕酮。
(四)雌激素
雌激素属甾体激素,非孕妇女主要由卵巢、肾上腺皮质合成。雌激素主要有雌酮(E1)、雌二醇(E2)及雌三醇(E3)。由于胎盘组织也能合成雌酮、雌二醇及雌三醇,故正常妊娠妇女的雌激素水平随妊娠月份进展而不断增高,到妊娠第7周时胎盘生成的雌激素已超过50%,因此妊娠期妇女除妊娠头几周外,胎盘才是雌激素的重要合成器官。
正常早期孕妇,雌酮、雌二醇主要来源于卵巢,雌三醇是前两者在外周组织的代谢产物。妊娠期雌激素75%-95%来源于胎儿-胎盘复合体。这是因为胎盘中合成雌激素的某些酶活性极低,而这些酶在胎儿肾上腺、胎肝内却十分丰富。因此要完成整个雌激素的合成与代谢,必须依赖正常的胎儿与胎盘的共同活动,即把胎儿与胎盘视为一个完整的功能单位与统一体,称之为胎儿-胎盘复合体。但此复合体又与母体不可分割,因为合成雌激素的前体来自母血供应。所以母体与胎儿-胎盘复合体在合成雌激素时三位一体,只不过胎盘是雌三醇最终生成部位而已。
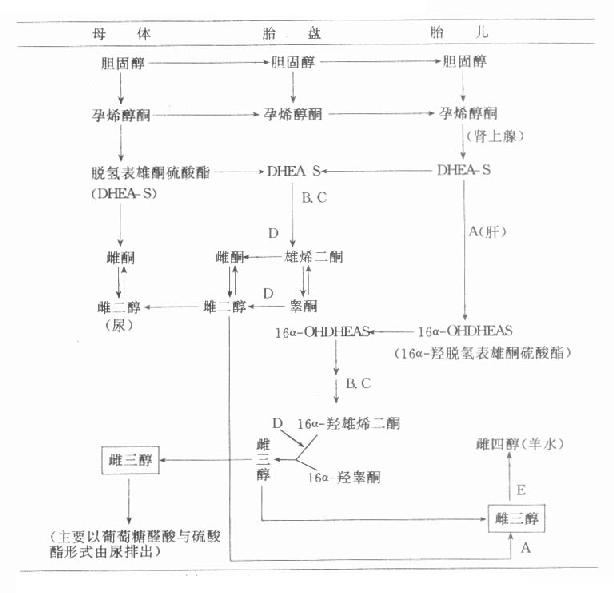
图14-2 胎儿-胎盘复合体雌激素合成途径
有关酶类:A=16α-羟化酶;B=硫酸酯酶;C=3β-羟化酶;D=芳香化酶;E=15α-羟化酶
从图14-1可见,胎儿也能利用从胎盘输送来的胆固醇,或自身合成的胆固醇作为原料,在C20-22裂解酶作用下转变成孕烯醇酮。胎儿肾上腺中存在活性很强的硫酸酯激酶,后者经17α-羟化酶作用下生成17α-羟孕烯醇酮硫酸酯,继而它又在C17-20裂解酶催化下生成脱氢表雄酮硫酯(dehydroepiandrosteronesul-fate,DHEAS)。胎儿生成的DHEAS可返回胎盘在硫酸酯酶及3β-羟化酶作用下生成雄烯二酮,成为合成雌激素的原料。
雄烯二酮可转变成睾酮,睾酮经胎盘内的芳香化酶作用生成雌二醇。雄烯二酮还可直接芳香化而成雌酮,胎盘生成的这两种激素可返回到母体内,成为孕妇血中激素最重要来源。胎儿体内生成的DHEAS还可在胎肝内存在的16α-羟化酶作用下生成16α-羟脱氢表雄酮硫酸酯(16α-OHDHEAS)。16α-OHDHEAS进入胎盘后生成16α-羟雄烯二酮及16α-羟睾酮,这两种雄激素经胎盘内芳香化酶作用转变成雌三醇,雌三醇可返回母体或进入胎儿体内(图14-2)。
胎盘生成的雌二醇在胎儿体内经16α-羟化酶作用转变为雌三醇,进入胎儿体内的雌三醇,在胎肝内经15α-羟化酶作用最科均生成雌四醇(图14-2)。胎儿生成的雌四醇可出现在羊水等体液内,孕妇尿液中的雌四醇的最主要来源也是最终经胎肝生成的。
正常妊娠期妇女血液激素组分的变化可参见表14-1。
表14-1 正常妊娠期血液激素组分的变化
| 激 素 | 非妊娠妇女(范围) | 妊娠后期妇女(范围) |
| 黄体生成素(LH mIU/ml) | 5-25 | <2 |
| 促卵泡成熟激素(FSH mIU/ml) | 2-15 | <2 |
| 垂体生乳素(PRL ng/ml) | 5-25 | 100-300 |
| 生长激素(GH ng/ml) | <5 | <7 |
| 促肾上腺皮质激素(ACTH ng/ml) | 7.8-120 | 12-60 |
| 总T4μg/dl | 5-12 | 7-8 |
| 总T3μg/dl | 50-250 | 120-280 |
| 可的松μg/dl | 5-25 | 10-40 |
| DOC ng/dl | 4-16 | 50-200 |
| 醛固酮ng/dl | 2-10 | 40-150 |
| 雌三醇ng/dl | 0.07-0.3 | 5-25 |
| 孕酮ng/dl | 1-25 | 7.0-250 |
| 1,25-(OH)2D3pg/ml | 10-90 | 20-200 |
| 关于“临床生物化学/胎盘激素”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |