G蛋白偶联受体
| A+医学百科 >> G蛋白偶联受体 |
| G蛋白偶联受体 GPCR | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 |
|||||||||
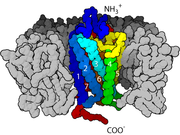
| 人κ-阿片肽受体与JDTic的复合物[1] | |||||||||
| 鉴定 | |||||||||
| 标志 | 7tm_1 | ||||||||
| Pfam(蛋白家族查询站) | PF00001 | ||||||||
| InterPro(蛋白数据整合站) | IPR000276 | ||||||||
| PROSITE(蛋白数据站) | PDOC00210 | ||||||||
| OPM家族(膜蛋白方向) | 6 | ||||||||
| OPM蛋白(膜蛋白方向) | 1gzm | ||||||||
|
|||||||||
G蛋白偶联受体(G Protein-Coupled Receptors, GPCRs),是一大类膜蛋白受体的统称。这类受体的共同点是其立体结构中都有七个跨膜α螺旋,且其肽链的C端和连接第5和第6个跨膜螺旋的胞内环上都有G蛋白(鸟苷酸结合蛋白)的结合位点。目前为止,研究显示G蛋白偶联受体只见于真核生物之中,而且参与了很多细胞信号转导过程。在这些过程中,G蛋白偶联受体能结合细胞周围环境中的化学物质并激活细胞内的一系列信号通路,最终引起细胞状态的改变。已知的与G蛋白偶联受体结合的配体包括气味,费洛蒙,激素,神经递质,趋化因子等等。这些受体可以是小分子的糖类,脂质,多肽,也可以是蛋白质等生物大分子。一些特殊的G蛋白偶联受体也可以被非化学性的刺激源激活,例如在感光细胞中的视紫红质可以被光所激活。与G蛋白偶联受体相关的疾病为数众多,并且大约40%的现代药物都以G蛋白偶联受体作为靶点。[2][3]
G蛋白偶联受体的下游信号通路有多种。与配体结合的G蛋白偶联受体会发生构象变化,从而表现出鸟苷酸交换因子(GEF)的特性,通过以三磷酸鸟苷(GTP)交换G蛋白上本来结合着的二磷酸鸟苷(GDP)使G蛋白的α亚基与β、γ亚基分离。这一过程使得G蛋白(特别地,指其与GTP结合着的α亚基)变为激活状态,并参与下一步的信号传递过程。具体的传递通路取决于α亚基的种类(:en:Gαs|Gαs, :en:Gαi|Gαi/o, :en:Gαq|Gαq/11, Gα12/13).[4]:1160其中主要的两个通路分别以由三磷酸腺苷环化产生的环腺苷酸(cAMP)和由磷脂酰肌醇-4,5-二磷酸(PIP2)水解生成的肌醇三磷酸(IP3)和甘油二酯(DAG)作为第二信使,[5] 详见环腺苷酸信号通路和磷脂酰肌醇信号通路。
目录 |
分类
根据对人的基因组进行序列分析所得的结果,人们预测出了近千种G蛋白偶联受体的基因。[6] 这些G蛋白偶联受体可以被划分为六个类型,分属其中的G蛋白偶联受体的基因序列之间没有同源关系。[7][8][9][10]
- A 类 (或 第一类) (视紫红质样受体)
- B 类 (或 第二类) (分泌素受体家族)
- C 类 (或 第三类) (代谢型谷氨酸受体)
- D 类 (或 第四类) (真菌交配信息素受体)
- E 类 (或 第五类) (环腺苷酸受体)
- F 类 (或 第六类) (Frizzled/Smoothened家族)
其中第一类即视紫红质样受体包含了绝大多数种类的G蛋白偶联受体。它被进一步分为了19个子类A1-A19。[11] 最近,有人提出了一种新的关于G蛋白偶联受体的分类系统,被称为GRAFS,即谷氨酸(Glutamate),视紫红质(Rhodopsin),粘附(Adhesion),Frizzled/Taste2以及分泌素(Secretin)的英文首字母缩写。[12]
一些基于生物信息学的研究着眼于预测那些具体功能尚未明了的G蛋白偶联受体的分类。[13] [14][15]研究者使用被称为伪氨基酸组成的方法利用G蛋白偶联受体的氨基酸系列来预测它们在生物体内可能的功能以及分类。
结构
G蛋白偶联受体均是膜内在蛋白,每个受体内包含七个α螺旋组成的跨膜结构域,这些结构域将受体分割为膜外N端,膜内C端,3个膜外环和3个膜内环。受体的膜外部分经常带有糖基化修饰。膜外环上包含有两个高度保守的半胱氨酸残基,它们可以通过形成二硫键稳定受体的空间结构。有些光敏感通道蛋白和G蛋白偶联受体有着相似的结构,也包含有七个跨膜螺旋,但同时也包含有一个跨膜的通道可供离子通过。
与G蛋白偶联受体相似,脂联素(例如ADIPOR1和ADIPOR2)也包含七个跨膜域,但是它们以相反的方向跨于膜上(即N端在膜内而C端在膜外),并且它们也不与G蛋白相互作用。[16]
早期关于G蛋白偶联受体结构的模型是基于他们与细菌视紫红质之间微弱的相似关系的,其中后者的结构已由电子衍射(蛋白质数据库资料编号:PDB 2BRD和PDB 1AT9)[17][18]和X射线晶体衍射(PDB 1AP9)实验所获得。[19]在2000年,第一个哺乳动物G蛋白偶联受体——牛视紫红质的晶体结构(PDB 1F88)被解出。[20] 2007年,第一个人类G蛋白偶联受体的结构(PDB 2R4R和PDB 2R4S)被解出。[21]随后不久,同一个受体的更高分辨率的结构(PDB 2RH1)被发表出来。[22][23]这个人G蛋白偶联受体——β2肾上腺素能受体,显示出与牛视紫红质的高度相似,不过两者在第二个膜外环的构象上完全不同。由于第二膜外环组成了一个类似盖子的结构罩住了配体结合位点,这个构象上的区别使得所有对从视紫红质建立G蛋白偶联受体同源结构模型的努力变得困难重重。
一些激活的即结合了配体的G蛋白偶联受体的结构也已经被研究清楚。[24][25][26][27]这些结构显示了G蛋白偶联受体的膜外部分与配体结合了之后会导致膜内部分发生构象变化。其中最显著的变化是第五和第六跨膜螺旋之间的膜内环会向外移动,而激活的β2肾上腺素能受体与G蛋白形成的复合体的结构显示了G蛋白α亚基正是结合在了上述运动所产生的一个空穴处。[28]
功能
G蛋白偶联受体参与众多生理过程。包括但不限于以下例子:
- 感光:视紫红质是一大类可以感光的G蛋白偶联受体。它们可以将电磁辐射信号转化成细胞内的化学信号,引导这一过程的反应称为光致异构化。具体细节为:由视蛋白和辅因子视黄醛共价连接所构成的视紫红质在光源的刺激下,分子内的视黄醛会发生异构化,从“11-顺式”变成“全反式”,这个变化进一步引起视蛋白的构象变化从而激活与之偶联的G蛋白,引发下游的信号传递过程。[29][30][31]
- 嗅觉:鼻腔内的嗅上皮和犁鼻器上分布有很多嗅觉受体,可以感知气味分子和费洛蒙。
- 行为和情绪的调节:哺乳动物的脑内有很多掌控行为和情绪的神经递质对应的受体是G蛋白偶联受体,包括血清素,多巴胺,γ-氨基丁酸和谷氨酸等。
- 免疫系统的调节:很多趋化因子通过G蛋白偶联受体发挥作用,这些受体被统称为趋化因子受体。其它属于此类的G蛋白偶联受体包括白介素受体和参与炎症与过敏反应的组胺受体等。
- 自主神经系统的调节:在脊椎动物中,交感神经和副交感神经的活动都受到G蛋白偶联受体信号通路的调节,它们控制着很多自律的生理功能,包括血压,心跳,消化等。
- 细胞密度的调节:最近在盘基网柄菌中发现了一种含有脂质激酶活性的G蛋白偶联受体,可以调控该种黏菌对细胞密度的感应。[32]
- 维持稳态:例如机体内水平衡的调节。[33]
机理
G蛋白偶联受体传递信号的机理包括几个主要步骤:首先来自细胞膜外侧的配体与受体相结合,引起后者的构象变化,这个过程也称为受体的激活。发生了构象变化的受体随即会激活附着在其细胞膜内侧端的G蛋白,表现为G蛋白上原先结合的GDP被替换为GTP。激活后的G蛋白会进一步引发一系列的下游效应,其中所涉及的具体信号通路则取决于G蛋白的种类。
配体结合位点
大部分A类受体的配体结合部位处于跨膜螺旋和胞外环附近,不过也有一些例外,如糖蛋白激素受体(GPHR)和富亮氨酸重复G蛋白偶联受体(LGR)等。其它类型的G蛋白偶联受体则主要以N端与配体结合。[34] 也有一些报道指出B类受体的跨膜螺旋上也存在潜在的变构配体结合位点。[35]
构象变化
G蛋白的激活/终止循环
配体
除了部分情况下可由可见光激活外,生理条件下正常工作的G蛋白偶联受体主要由配体分子所激活。可以与G蛋白偶联受体结合的配体涵盖了很多种类的信号分子,包括各种气味分子、腺苷、肝细胞生长因子、一些生物胺(如多巴胺、肾上腺素、去甲肾上腺素、组胺和血清素等)、谷氨酸(通过代谢型谷氨酸受体)、胰高血糖素、乙酰胆碱(通过毒蕈碱型乙酰胆碱受体)、大麻素、趋化因子、介导炎症反应的一些脂质(如前列腺素等类花生酸、血小板活化因子和白三烯等)以及众多肽类激素(如降钙素、生长抑素、生长激素、部分血管活性肠肽家族的成员、抗利尿激素、过敏毒素、促卵泡激素、促性腺激素释放激素、速激肽、缓激肽、蛙皮素、内皮素、γ-氨基丁酸、黑素皮质激素、神经肽Y、阿片肽、促甲状腺素释放激素和催产素等)。另外,也有些G蛋白偶联受体虽然已经确定是某种刺激的受体,但是其内源配体尚未被发现,这样的G蛋白偶联受体同其它类似的受体一起被归类为孤儿受体。
第二信使系统
环腺苷酸信号通路
磷脂酰肌醇信号通路
下游信号通路
对G蛋白偶联受体的调控
参考资料
- ↑ Huixian Wu, Daniel Wacker, Mauro Mileni, Vsevolod Katritch, GyeWon Han, Eyal Vardy, Wei Liu, Aaron A. Thompson, Xi-Ping Huang, F. Ivy Carroll, S. Wayne Mascarella, Richard B. Westkaemper, Philip D. Mosier, Bryan L. Roth, Vadim Cherezov & Raymond C. Stevens. Structure of the human k-opioid receptor in complex with JDTic. Nature. 2012. doi:10.1038/nature10939.
- ↑ Filmore, David. It's a GPCR world. Modern Drug Discovery. American Chemical Society. 2004, 2004 (November): 24–28.
- ↑ Overington JP, Al-Lazikani B, Hopkins AL. How many drug targets are there?. Nat Rev Drug Discov. December 2006, 5 (12): 993–6. doi:10.1038/nrd2199. PMID 17139284.
- ↑ Wettschureck N, Offermanns S. Mammalian G proteins and their cell type specific functions. Physiol. Rev.. October 2005, 85 (4): 1159–204. doi:10.1152/physrev.00003.2005. PMID 16183910.
- ↑ Gilman A.G.. G Proteins: Transducers of Receptor-Generated Signals. Annual Review of Biochemistry. 1987, 56: 615–649. doi:10.1146/annurev.bi.56.070187.003151. PMID 3113327.
- ↑ Vassilatis DK, Hohmann JG, Zeng H, Li F, Ranchalis JE et al. The G protein-coupled receptor repertoires of human and mouse. Proc Natl Acad Sci USA. 2003, 100 (8): 4903–4908. doi:10.1073/pnas.0230374100. PMID 12679517. PMC 153653.
- ↑ Attwood TK, Findlay JB. Fingerprinting G-protein-coupled receptors. Protein Eng. 1994, 7 (2): 195–203. doi:10.1093/protein/7.2.195. PMID 8170923.
- ↑ Kolakowski LF Jr. GCRDb: a G-protein-coupled receptor database. Receptors Channels. 1994, 2 (1): 1–7. PMID 8081729.
- ↑ Foord SM, Bonner TI, Neubig RR, Rosser EM, Pin JP, Davenport AP, Spedding M, Harmar AJ. International Union of Pharmacology. XLVI. G protein-coupled receptor list. Pharmacol Rev. 2005, 57 (2): 279–88. doi:10.1124/pr.57.2.5. PMID 15914470.
- ↑ InterPro
- ↑ Joost P, Methner A. [http//www.ncbi.nlm.nih.gov/pmc/articles/PMC133447/ Phylogenetic analysis of 277 human G-protein-coupled receptors as a tool for the prediction of orphan receptor ligands]. Genome Biol. 2002, 3 (11): research0063.1–0063.16. doi:10.1186/gb-2002-3-11-research0063. PMID 12429062. PMC 133447.
- ↑ Bjarnadottir TK, Gloriam DE, Hellstrand SH, Kristiansson H, Fredriksson R, Schioth HB. Comprehensive repertoire and phylogenetic analysis of the G protein-coupled receptors in human and mouse. Genomics. 2006, 88 (3): 263–73. doi:10.1016/j.ygeno.2006.04.001. PMID 16753280.
- ↑ Xiao X, Wang P, Chou KC. A cellular automaton image approach for predicting G-protein-coupled receptor functional classes. Journal of Computational Chemistry. 2009, 30 (9): 1414–1423. doi:10.1002/jcc.21163. PMID 19037861.
- ↑ Qiu JD, Huang JH, Liang RP, Lu XQ. Prediction of G-protein-coupled receptor classes based on the concept of Chou's pseudo amino acid composition: an approach from discrete wavelet transform. Anal. Biochem.. July 2009, 390 (1): 68–73. doi:10.1016/j.ab.2009.04.009. PMID 19364489.
- ↑ Gu Q, Ding YS, Zhang TL. Prediction of G-Protein-Coupled Receptor Classes in Low Homology Using Chou's pseudo amino acid composition with Approximate Entropy and Hydrophobicity Patterns. Protein Pept. Lett.. May 2010, 17 (5): 559–67. doi:10.2174/092986610791112693. PMID 19594431.
- ↑ Yamauchi T, Kamon J, Ito Y, Tsuchida A, Yokomizo T, Kita S, Sugiyama T, Miyagishi M, Hara K, Tsunoda M, Murakami K, Ohteki T, Uchida S, Takekawa S, Waki H, Tsuno NH, Shibata Y, Terauchi Y, Froguel P, Tobe K, Koyasu S, Taira K, Kitamura T, Shimizu T, Nagai R, Kadowaki T. Cloning of adiponectin receptors that mediate antidiabetic metabolic effects. Nature. June 2003, 423 (6941): 762–9. doi:10.1038/nature01705. PMID 12802337.
- ↑ Grigorieff N, Ceska TA, Downing KH, Baldwin JM, Henderson R. Electron-crystallographic refinement of the structure of bacteriorhodopsin. J. Mol. Biol.. 1996, 259 (3): 393–421. doi:10.1006/jmbi.1996.0328. PMID 8676377.
- ↑ Kimura Y, Vassylyev DG, Miyazawa A, Kidera A, Matsushima M, Mitsuoka K, Murata K, Hirai T, Fujiyoshi Y. Surface of bacteriorhodopsin revealed by high-resolution electron crystallography. Nature. 1997, 389 (6647): 206–11. doi:10.1038/38323. PMID 9296502.
- ↑ Pebay-Peyroula E, Rummel G, Rosenbusch JP, Landau EM. X-ray structure of bacteriorhodopsin at 2.5 angstroms from microcrystals grown in lipidic cubic phases. Science. 1997, 277 (5332): 1676–81. doi:10.1126/science.277.5332.1676. PMID 9287223.
- ↑ Palczewski K, Kumasaka T, Hori T, Behnke CA, Motoshima H, Fox BA, Trong IL, Teller DC, Okada T, Stenkamp RE, Yamamoto M, Miyano M. Crystal structure of rhodopsin: A G protein-coupled receptor. Science. 2000, 289 (5480): 739–45. doi:10.1126/science.289.5480.739. PMID 10926528.
- ↑ Rasmussen SG, Choi HJ, Rosenbaum DM, Kobilka TS, Thian FS, Edwards PC, Burghammer M, Ratnala VR, Sanishvili R, Fischetti RF, Schertler GF, Weis WI, Kobilka BK. Crystal structure of the human β2-adrenergic G-protein-coupled receptor. Nature. 2007, 450 (7168): 383–7. doi:10.1038/nature06325. PMID 17952055.
- ↑ Cherezov V, Rosenbaum DM, Hanson MA, Rasmussen SG, Thian FS, Kobilka TS, Choi HJ, Kuhn P, Weis WI, Kobilka BK, Stevens RC. [http//www.ncbi.nlm.nih.gov/pmc/articles/PMC2583103/ High-resolution crystal structure of an engineered human β2-adrenergic G protein-coupled receptor]. Science. 2007, 318 (5854): 1258–65. doi:10.1126/science.1150577. PMID 17962520. PMC 2583103.
- ↑ Rosenbaum DM, Cherezov V, Hanson MA, Rasmussen SG, Thian FS, Kobilka TS, Choi HJ, Yao XJ, Weis WI, Stevens RC, Kobilka BK. GPCR engineering yields high-resolution structural insights into β2-adrenergic receptor function. Science. 2007, 318 (5854): 1266–73. doi:10.1126/science.1150609. PMID 17962519.
- ↑ Rasmussen SG, Choi HJ, Fung JJ, Pardon E, Casarosa P, Chae PS, Devree BT, Rosenbaum DM, Thian FS, Kobilka TS, Schnapp A, Konetzki I, Sunahara RK, Gellman SH, Pautsch A, Steyaert J, Weis WI, Kobilka BK. [http//www.ncbi.nlm.nih.gov/pmc/articles/PMC3058308/ Structure of a nanobody-stabilized active state of the β(2) adrenoceptor]. Nature. January 2011, 469 (7329): 175–80. doi:10.1038/nature09648. PMID 21228869. PMC 3058308.
- ↑ Rosenbaum DM, Zhang C, Lyons JA, Holl R, Aragao D, Arlow DH, Rasmussen SG, Choi HJ, Devree BT, Sunahara RK, Chae PS, Gellman SH, Dror RO, Shaw DE, Weis WI, Caffrey M, Gmeiner P, Kobilka BK. [http//www.ncbi.nlm.nih.gov/pmc/articles/PMC3074335/ Structure and function of an irreversible agonist-β(2) adrenoceptor complex]. Nature. January 2011, 469 (7329): 236–40. doi:10.1038/nature09665. PMID 21228876. PMC 3074335.
- ↑ Warne T, Moukhametzianov R, Baker JG, Nehmé R, Edwards PC, Leslie AG, Schertler GF, Tate CG. [http//www.ncbi.nlm.nih.gov/pmc/articles/PMC3023143/ The structural basis for agonist and partial agonist action on a β(1)-adrenergic receptor]. Nature. January 2011, 469 (7329): 241–4. doi:10.1038/nature09746. PMID 21228877. PMC 3023143.
- ↑ Xu F, Wu H, Katritch V, Han GW, Jacobson KA, Gao ZG, Cherezov V, Stevens RC. [http//www.ncbi.nlm.nih.gov/pmc/articles/PMC3086811/ Structure of an agonist-bound human A2A adenosine receptor]. Science. April 2011, 332 (6027): 322–7. doi:10.1126/science.1202793. PMID 21393508. PMC 3086811.
- ↑ Rasmussen SG, Devree BT, Zou Y, Kruse AC, Chung KY, Kobilka TS, Thian FS, Chae PS, Pardon E, Calinski D, Mathiesen JM, Shah ST, Lyons JA, Caffrey M, Gellman SH, Steyaert J, Skiniotis G, Weis WI, Sunahara RK, Kobilka BK. [http//www.ncbi.nlm.nih.gov/pmc/articles/PMC3184188/ Crystal structure of the β(2) adrenergic receptor-Gs protein complex]. Nature. July 2011, 477 (7366): 549–55. doi:10.1038/nature10361. PMID 21772288. PMC 3184188.
- ↑ Stuart JA, Brige RR. Characterization of the primary photochemical events in bacteriorhodopsin and rhodopsin//Lee AG. Rhodopsin and G-Protein Linked Receptors, Part A (Vol 2, 1996) (2 Vol Set). Greenwich, Conn: JAI Press. 1996: pp. 33–140. ISBN 1-55938-659-2.
- ↑ Hofmann KP, Heck M. Light-induced protein-protein interactions on the rod photoreceptor disc membrane//Lee AG. Rhodopsin and G-Protein Linked Receptors, Part A (Vol 2, 1996) (2 Vol Set). Greenwich, Conn: JAI Press. 1996: pp. 141–198. ISBN 1-55938-659-2.
- ↑ Kolb H, Fernandez E, Nelson R, Jones BW. Webvision: Photoreceptors. University of Utah. 2010-03-01.
- ↑ Bakthavatsalam D, Brazill D, Gomer RH, Eichinger L, Rivero F, Noegel AA. A G protein-coupled receptor with a lipid kinase domain is involved in cell-density sensing. Curr Biol. 2007, 17 (10): 892–7. doi:10.1016/j.cub.2007.04.029. PMID 17481898.
- ↑ Hazell GG, Hindmarch CC, Pope GR, Roper JA, Lightman SL, Murphy D, O'Carroll AM, Lolait SJ. [http//www.ncbi.nlm.nih.gov/pmc/articles/PMC3336209/ G protein-coupled receptors in the hypothalamic paraventricular and supraoptic nuclei - serpentine gateways to neuroendocrine homeostasis]. Front Neuroendocrinol. July 2011, 33 (1): 45–66. doi:10.1016/j.yfrne.2011.07.002. PMID 21802439. PMC 3336209.
- ↑ Lagerstrom MC et al. Structural diversity of G protein-coupled receptors and significance for drug discovery. Nat Rev Drug Discov. April 2008, 7 (4): 339-57. PMID 18382464.
- ↑ Bhattacharya S et al. Allosteric antagonist binding sites in class B GPCRs: corticotropin receptor 1. J Comput Aided Mol Des. August 2010, 24 (8): 659-74. PMID 20512399.
参见
- 代谢型受体
- G蛋白偶联受体数据库
- 美国科学家罗伯特·莱夫科维茨与布莱恩·克比尔卡,因该领域的研究成果而获得2012年诺贝尔化学奖
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
参考来源
| 关于“G蛋白偶联受体”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |