被动运输
| A+医学百科 >> 被动运输 |
被动运输
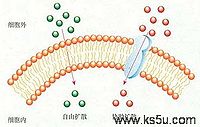
一、简单扩散
也叫自由扩散(free diffusing),特点是:①沿浓度梯度(或电化学梯度)扩散;②不需要提供能量;③没有膜蛋白的协助。
某种物质对膜的通透性(P)可以根据它在油和水中的分配系数(K)及其扩散系数(D)来计算:
P=KD/t,t为膜的厚度。
脂溶性越高通透性越大,水溶性越高通透性越小;非极性分子比极性容易透过,小分子比大分子容易透过。具有极性的水分子容易透过是因水分子小,可通过由膜脂运动而产生的间隙。
非极性的小分子如O2、CO2、N2可以很快透过脂双层,不带电荷的极性小分子,如水、尿素、甘油等也可以透过人工脂双层,尽管速度较慢,分子量略大一点的葡萄糖、蔗糖则很难透过,而膜对带电荷的物质如:H+、Na+、K+、Cl—、HCO3-是高度不通透的
事实上细胞的物质转运过程中,透过脂双层的简单扩散现象很少,绝大多数情况下,物质是通过载体或者通道来转运的。离子、葡萄糖、核苷酸等物质有的是通过质膜上的运输蛋白的协助,按浓度梯度扩散进入质膜的,有的则是通过主动运输的方式进行转运。
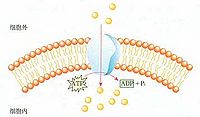
二、协助扩散
也称促进扩散(faciliatied diffusion),其运输特点是: ①比自由扩散转运速率高; ②存在最大转运速率; 在一定限度内运输速率同物质浓度成正比。如超过一定限度,浓度再增加,运输也不再增加。因膜上载体蛋白的结合位点已达饱和; ③有特异性,即与特定溶质结合。这类特殊的载体蛋白主要有离子载体和通道蛋白两种类型。
(一)离子载体
离子载体(ionophore),是疏水性的小分子,可溶于双脂层,提高所转运离子的通透率,多为微生物合成,是微生物防御被捕食或与其它物种竞争的武器,
离子载体也是以被动的运输方式运输离子,可分成可动离子载体(mobile ion carrier)和通道离子载体(channel former)两类:
可动离子载体:如缬氨霉素(valinomycin)能在膜的一侧结合K+,顺着电化学梯度通过脂双层,在膜的另一侧释放K+,且能往返进行(图5-2)。其作用机理就像虹吸管可以使玻璃杯中的水跨越杯壁屏障,向低处流动一样。此外,2,4-二硝基酚(DNP)、羰基-氰-对-三氟甲氧基苯肼(FCCP)可转运H+,离子霉素(ionomycin)、A23187可转运Ca2+。
图5-2 缬氨霉素的分子结构
通道离子载体:如短杆菌肽A(granmicidin)是由15个疏水氨基酸构成的短肽,2分子的短杆菌肽形成一个跨膜通道,有选择的使单价阳离子如H+、Na+、K+按化学梯度通过膜,这种通道并不稳定,不断形成和解体,其运输效率远高于可动离子载体(图5-3)。
图5-3 短杆菌肽构成的通道
(二)通道蛋白
通道蛋白(channel protein)是衡跨质膜的亲水性通道,允许适当大小的离子顺浓度梯度通过,故又称离子通道。有些通道蛋白形成的通道通常处于开放状态,如钾泄漏通道,允许钾离子不断外流。有些通道蛋白平时处于关闭状态,即“门”不是连续开放的,仅在特定刺激下才打开,而且是瞬时开放瞬时关闭,在几毫秒的时间里,一些离子、代谢物或其他溶质顺着浓度梯度自由扩散通过细胞膜,这类通道蛋白又称为门通道(gated channel)。
门通道可以分为四类(图5-4):配体门通道(ligand gated channel)、电位门通道(voltage gated channel)、环核苷酸门通道(Cyclic Nucleotide-Gated Ion Channels)和机械门通道(mechanosensitive channel)。
不同通道对不同离子的通透性不同,即离子选择性(ionic selectivity)。这是由通道的结构所决定的,只允许具有特定离子半径和电荷的离子通过。根据离子选择性的不同,通道可分为钠通道、钙通道、钾通道、氯通道等。但通道的离子选择性只是相对的而不是绝对的,比如,钠通道除主要对Na+通透外,对NH4+也通透,甚至于对K+也稍有通透。
图5-4 各类离子通道
1、配体门通道
表面受体与细胞外的特定物质(配体ligand)结合,引起门通道蛋白发生构象变化,结果使“门”打开,又称离子通道型受体。分为阳离子通道,如乙酰胆碱、谷氨酸和五羟色胺的受体,和阴离子通道,如甘氨酸和γ-氨基丁酸的受体。
N型乙酰胆碱受体[1]是目前了解较多的一类配体门通道。它是由4种不同的亚单位组成的5聚体,总分子量约为290kd。亚单位通过氢键等非共价键,形成一个结构为α2βγδ的梅花状通道样结构,其中的两个α亚单位是同两分子Ach相结合的部位(图5-5)。
Ach门通道具有具有三种状态:开启、关闭和失活。当受体的两个α亚单位结合Ach时,引起通道构象改变,通道瞬间开启,膜外Na+内流,膜内K+外流。使该处膜内外电位差接近于0值,形成终板电位,然后引起肌细胞动作电位,肌肉收缩。即是在结合Ach时,Ach门通道也处于开启和关闭交替进行的状态,只不过开启的概率大一些(90%)。Ach释放后,瞬间即被乙酰胆碱酯酶水解,通道在约1毫秒内关闭。如果Ach存在的时间过长(约20毫秒后),则通道会处于失活状态。
筒箭毒和α银环蛇毒素可与乙酰胆碱受体结合,但不能开启通道,导致肌肉麻痹。
图5-5 乙酰胆碱受体
2、电位门通道
电位门通道(voltage gated channel)是对细胞内或细胞外特异离子浓度发生变化时,或对其他刺激引起膜电位变化时,致使其构象变化,“门”打开。如:神经肌肉接点由Ach门控通道开放而出现终板电位时,这个电位改变可使相邻的肌细胞膜中存在的电位门Na+通道和K+通道相继激活(即通道开放),引起肌细胞动作电位;动作电位传至肌质网,Ca2+通道打开引起Ca2+外流,引发肌肉收缩。
根据对Na+、K+、Ca2+通道蛋白质的结构分析,发现它们一级结构中的氨基酸排列有相当大的同源性,属于同一蛋白质家族,是由同一个远祖基因演化而来。K+电位门通道由四个α亚单位(I-IV)构成(图5-6),每个亚单位均有6个(S1-S6)跨膜α螺旋节段,N和C端均位于胞质面。连接S5-S6段的发夹样β折叠 (P区或H5区),构成通道的内衬,大小可允许K+通过。
K+通道具有三种状态:开启、关闭和失活。目前认为S4段是电压感受器, S4高度保守,属于疏水片段,但每隔两个疏水残基即有一个带正电荷的精氨酸或赖氨酸残基。S4段上的正电荷可能是门控电荷,当膜去极化时(膜外为负,膜内为正),引起带正电荷的氨基酸残基转向细胞外侧面,通道蛋白构象改变,“门”打开,大量K+外流,此时相当于K+的自由扩散。K+电位门它和Ach配体门一样只是瞬间(约几毫秒)开放,然后失活。此时N端的球形结构,堵塞在通道中央,通道失活,稍后球体释放,“门”处于关闭状态。
链霉菌(Streptomyces lividans)的钾离子通道KcsA也是由四个亚单位构成的,但每个亚基只有两个跨膜片段,结构较为简单。1998年,Roderick MacKinnon 等用X射线衍射技术获得了高分辨的KcsA通道图像,发现离子通透过程中离子的选择性主要发生在狭窄的选择性过滤器中。选择性过滤器长1.2nm,孔径约为0.3nm(K+脱水后直径约0.26nm),内部形成一串钾离子特异结合位点,从而只有钾离子能够“排队”通过通道。
河豚毒素(Tetrodotoxin,TTX)能阻滞钠通道,毒素带正电荷的胍基伸人钠通道的离子选择性过滤器,和通道内壁上的游离羧基结合,毒素其余部分堵塞通道外侧端,妨碍钠离子进入,导致肌肉麻痹。
图5-6 钾电位门通道
3、环核苷酸门通道
与电压门控性通道家族关系密切的是CNG通道,从蛋白质序列来看,它们与电压门钾通道结构相似,也有6个跨膜片段,各为带电荷片段,P区构成孔道内侧,整个通道为四聚体结构。在CNG通道中,细胞内的C末端较长,上面含有环核苷酸的结合位点。
环核苷酸门通道分布于化学感受器和光感受器中,与膜外信号的转换有关。如气味分子与化学感受器中的G蛋白偶联型受体结合,可激活腺苷酸环化酶,产生cAMP,开启cAMP门控阳离子通道(cAMP-gated cation channel),引起钠离子内流,膜去极化,产生神经冲动,最终形成嗅觉或味觉。
4、机械门通道
细胞可以接受各种各样的机械力刺激,如摩擦力、压力、牵拉力、重力、剪切力等。细胞将机械刺激的信号转化为电化学信号最终引起细胞反应的过程称为机械信号转导(mechanotransduction)。
目前比较明确的有两类机械门通道,其一是牵拉活化或失活的离子通道,另一类是剪切力敏感的离子通道,前者几乎存在于所有的细胞膜,研究较多的有血管内皮细胞、心肌细胞以及内耳中的毛细胞等,后者仅发现于内皮细胞和心肌细胞。牵拉敏感的离子通道是指能直接被细胞膜牵拉所开放或关闭的离子通道。其特点为对离子的无选择性、无方向性、非线性以及无潜伏期。这种通道为2价或1价的阳离子通道,有Na+、K+、Ca2+,以Ca2+为主。研究表明,当内皮细胞被牵拉时,由于通道开放引起Ca2+内流,使以Ca2+介导的血管活性物质分泌增多,Ca2+还可作为胞内信使,导致进一步的反应。
内耳毛细胞顶部的听毛也是对牵拉力敏感的感受装置,听毛弯曲时,毛细胞会出现暂短的感受器电位。从听毛受力而致听毛根部所在膜的变形,到该处膜出现跨膜离子移动之间,只有极短的潜伏期,
5、水通道
长期以来, 普遍认为细胞内外的水分子是以简单扩散的方式透过脂双层膜。后来发现某些细胞在低渗溶液中对水的通透性很高, 很难以简单扩散来解释。如将红细胞移入低渗溶液后,很快吸水膨胀而溶血,而水生动物的卵母细胞在低渗溶液不膨胀。因此,人们推测水的跨膜转运除了简单扩散外, 还存在某种特殊的机制, 并提出了水通道的概念。
1988年Agre在分离纯化红细胞膜上的Rh血型抗原时,发现了一个 KD 的疏水性跨膜蛋白,称为CHIP28 (Channel-Forming integral membrane protein),1991年得到CHIP28的cDNA 序列,Agre将CHIP28的mRNA注入非洲爪蟾的卵母细胞中,在低渗溶液中,卵母细胞迅速膨胀,并于5 分钟内破裂,纯化的CHIP28置入脂质体,也会得到同样的结果。细胞的这种吸水膨胀现象会被Hg2+抑制,而这是已知的抑制水通透的处理措施。这一发现揭示了细胞膜上确实存在水通道,Agre因此而与离子通道的研究者Roderick MacKinnon共享2003年的诺贝尔化学奖。
目前在人类细胞中已发现的此类蛋白至少有11种,被命名为水通道蛋白(Aquaporin,AQP),均具有选择性的让水分子通过的特性。在实验植物拟南芥(Arabidopsis thaliana)中已发现35个这类水通道。
水通道的活性调节可能具有以下途径:通过磷酸化使AQP的活性增强;通过膜跑运输改变膜上AQP的含量,如血管加压素(抗利尿激素) 对肾脏远曲小管和集合小管上皮细胞水通透性调节;通过调节基因表达,促进AQP的合成。
[1]按照受体结构和对药物反应的不同,Ach受体分为两大类:被毒蕈碱(Muscarine)激动的Ach受体称为毒蕈碱型Ach受体(M-AchR),被烟碱(Nicotine)激动的Ach受体称为烟碱型Ach受体(N-AchR),前者主要分布于副交感神经节后纤维和极少数交感神经节后纤维支配的效应器膜上,后者可分为神经型和肌肉型。
|
|||||||||||||||||||||
| 关于“被动运输”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |