拉氏图
| A+医学百科 >> 拉氏图 |
拉氏图(又名 Ramachandran 图,[φ,ψ]图, α-碳与酰胺平面交角图,英名 Ramachandran plot, Ramachandran diagram, 或 [φ,ψ] plot),起初是于1963年被 G. N. Ramachandran,C. Ramakrishnan 和 V. Sasisekharan 提出的,是一种使蛋白质结构中,主链氨基酸残基的二面角 ψ 和 φ 可视化的方法。
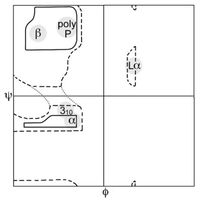
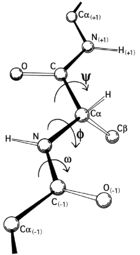
左侧的图形说明了主链二面角φ 和 ψ 的定义(当时被Ramachandran叫做 φ 和 φ')。肽键处的 ω 角通常是 180°,因为肽键部分双键的性质使它保持平面结构。右上方的图,则展示了由 Ramachandran 等人于 1963年 至 1968年根据刚性球面模型计算出来的主链 φ,ψ 角允许的构象区域:完全允许的以实线表示,部分允许的则是虚线,点线则表示松弛的τ(N-Cα-C)角。由于二面角的值 0° 和 360° 是等效的,拉氏图的边缘可以从左到右和从上到下“卷”起来。比如说,左下角的允许区的小条就可以与左上方的大的构象允许区域连接起来。
目录 |
应用
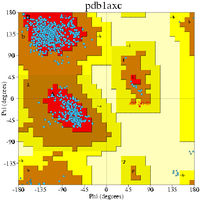
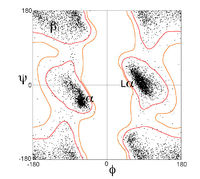
拉氏图可以用于多少有些不同的两种方面。一个从理论上展示哪些 ψ 和 φ 角的值,或者说构象,对蛋白质中的氨基酸残基(如右上图)是有可能的。其二是展示观测数据点的经验分布(如右图),用于结构确认中,或者在许多结构所组成的数据库中(如左下3幅图所示)。这两种情况均常用于展示理论偏好区域的外形。
氨基酸偏好
可以预料,更大的侧链将会导致其更受限制,从而表现在拉氏图上是一个更小的允许区域。实际上看起来并不是这样;只有β-位碳原子处的亚甲基的影响比较大。甘氨酸的侧链只是一个氢原子,比起所有其它氨基酸侧链开头的 -CH3, -CH2-, 或-CH< 有一个更小的范德华半径,所以它是受限制最小的,这在甘氨酸的拉氏图中(见左图,甘氨酸)可以看出,其允许区域大多了。相反,脯氨酸的拉氏图,由于其侧链与主链 α-C 及 N 形成五元环,则表现出 ψ 和 φ 的非常有限的可能组合(见左图,脯氨酸)
近期的更新
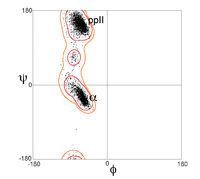
第一个拉氏图于原子水平的蛋白质结构(肌红蛋白,1960)首次测定后被计算出来,虽然其结论是基于短肽的小分子晶体学上。如今,几十年过去了,已经有几万种通过X-射线晶体学测定并存储于蛋白质资料库的蛋白质的高分辨率结构。很多研究已经利用了这个数据以产生更加详细精确的φ,ψ图(Morris et al. 1992;[1] Kleywegt & Jones 1996;[2] Hooft et al. 1997;[3] Hovmöller et al. 2002;[4] Lovell et al. 2003[5])。左侧的三个图展示了来自一系列高分辨率的结构的数据点以及通常情况(除甘氨酸,脯氨酸及 pre-Pro之外所有氨基酸),甘氨酸及脯氨酸的偏好和允许的构象区域的轮廓。最常见的区域标记如下:α 表示 α-螺旋,Lα 表示左旋α-螺旋,β 表示 β-折叠,ppII表示聚脯氨酸II。
相关
也可以对多糖以及其它聚合物中的二面角类似作图(例如,通过CARP等)。对蛋白质的前两个侧链二面角有一个相似的图:Janin图。
相关软件
- Ramachandran plot 2.0
- Web-based tool showing Ramachandran plot of any PDB entry
- MolProbity web service that produces Ramachandran plots and other validation of any PDB-format file
- STING
- Pymol,具有 DynoPlot 扩展。
- VMD, distributed with dynamic Ramachandran plot plugin
- WHAT_CHECK,来自 WHAT_IF_software 的独立验证的程序。
- UCSF Chimera,可以在 Model Panel 中找到。
- Sirius
- Swiss PDB Viewer
- TALOS
可以参见 PDB 以获取相似软件的一个清单。
参考来源
- ↑ Morris, A.L.; MacArthur, M.W.; Hutchinson, E G.; Thornton, J.M.. Stereochemical quality of protein structure coordinates. Proteins: Structure, Function, and Genetics. 1992, 12 (4): 345–64. doi:10.1002/prot.340120407. PMID 1579569.
- ↑ Kleywegt, G.J.; Jones, T.A.. Phi/psi-chology: Ramachandran revisited. Structure. 1996, 4 (12): 1395–400. doi:10.1016/S0969-2126(96)00147-5. PMID 8994966.
- ↑ Hooft, R.W.W.; Sander, C.; Vriend, G.. Objectively judging the quality of a protein structure from a Ramachandran plot. Comput Appl Biosci. 1997, 13 (4): 425-430. doi:10.1093/bioinformatics/13.4.425.
- ↑ Hovmöller, S.; Zhou, T.; Ohlson, T.. Conformations of amino acids in proteins. Acta Crystallographica D. 2002, 58 (Pt 5): 768–76. doi:10.1107/S0907444902003359. PMID 11976487.
- ↑ Lovell, S.C.; Davis, I.W.; Arendall, W.B.; De Bakker, P.I.W.; Word, J.M.; Prisant, M.G.; Richardson, J.S.; Richardson, D.C.. Structure validation by Cα geometry: ϕ,ψ and Cβ deviation. Proteins: Structure, Function, and Genetics. 2003, 50 (3): 437–50. doi:10.1002/prot.10286. PMID 12557186.
更多阅读
- 张楚富. 生物化学原理. ISBN 978-7-04-029978-6 (简体中文).
|
|||||||||||
|
|||||||||||
参考来源
| 关于“拉氏图”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |