细胞粘附分子
| A+医学百科 >> 细胞粘附分子 |
细胞粘附分子(cell adhesion molecule,CAM)是参与细胞与细胞之间及细胞与细胞外基质之间相互作用的分子。
细胞粘附指细胞间的粘附,是细胞间信息交流的一种形式。而信息交流的可溶递质称细胞粘附分子(cell adhesion molecule,CAM)。CAM是一类独立的分子结构,是通过识别与其粘附的特异性受体而发生相互间的粘附现象。
目录 |
细胞粘附分子的组成
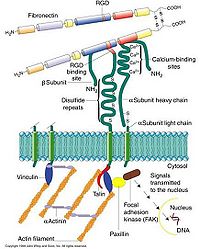
细胞粘附分子都是跨膜糖蛋白,分子结构由三部分组成:①胞外区,肽链的N端部分,带有糖链,负责与配体的识别;②跨膜区,多为一次跨膜;③胞质区,肽链的C端部分,一般较小,或与质膜下的骨架成分直接相连,或与胞内的化学信号分子相连,以活化信号转导途径。
多数细胞粘附分子的作用依赖于二价阳离子,如Ca2+,Mg2+。细胞粘附分子的作用机制有三种模式(图11-16):两相邻细胞表面的同种CAM分子间的相互识别与结合(亲同性粘附);两相邻细胞表面的不同种CAM分子间的相互识别与结合(亲异性粘附);两相邻细胞表面的相同CAM分子借细胞外的连接分子相互识别与结合。
细胞粘附分子的分类
可大致分为五类:钙粘素、选择素、免疫球蛋白超家族、整合素及透明质酸粘素。
一、钙粘素
钙粘素(cadherin)属亲同性CAM,其作用依赖于Ca2+。至今已鉴定出30种以上钙粘素,分布于不同的组织。
钙粘素分子结构同源性很高,其胞外部分形成5个结构域,其中4个同源,均含Ca2+结合部位。决定钙粘素结合特异性的部位在靠N末端的一个结构域中,只要变更其中2个氨基酸残基即可使结合特异性由E-钙粘素转变为P-钙粘素。钙粘素分子的胞质部分是最高度保守的区域,参与信号转导。
钙粘素通过不同的连接蛋白质与不同的细胞骨架成分相连,如E-钙粘素通过α-、β-、γ-连锁蛋白(catenin)以及粘着斑蛋白(vinculin)、锚蛋白、α辅肌动蛋白等与肌动蛋白纤维相连;桥粒中的desmoglein及desmocollin则通过桥粒致密斑与中间纤维相连。
钙粘素的作用主要有以下几个方面:
1.介导细胞连接,在成年脊椎动物,E-钙粘素是保持上皮细胞相互粘合的主要CAM,是粘合带的主要构成成分。桥粒中的钙粘素就是desmoglein及desmocollin。
2.参与细胞分化,钙粘素对于胚胎细胞的早期分化及成体组织(尤其是上皮及神经组织)的构筑有重要作用。在发育过程中通过调控钙粘素表达的种类与数量可决定胚胎细胞间的相互作用(粘合、分离、迁移、再粘合),从而通过细胞的微环境,影响细胞的分化,参与器官形成过程。
3.抑制细胞迁移,很多种癌组织中细胞表面的E钙粘素减少或消失,以致癌细胞易从瘤块脱落,成为侵袭与转移的前提。因而有人将E钙粘素视为转移抑制分子。
二、选择素
选择素(selectin)属亲异性CAM,其作用依赖于Ca2+。主要参与白细胞与脉管内皮细胞之间的识别与粘合。已知选择素有三种:L选择素、E选择素及P选择素。
选择素的胞外区由三个结构域构成:N端的C型凝集素结构域,EGF样结构域、重复次数不同的补体结合蛋白结构域;通过凝集素结构域来识别糖蛋白及糖脂分子上的糖配体。
E选择素及P选择素所识别与结合的糖配体为唾液酸化及岩藻糖化的N乙酰氨基乳糖结构(sLeX及sLeA)。sLeA结构存在于髓系白细胞表面(其中包括L选择素)分子中。多种肿瘤细胞表面也存在sLeX及sLeA结构。
P选择素贮存于血小板的α颗粒及内皮细胞的Weibel-Palade小体。炎症时活化的内皮细胞表面首先出现P选择素,随后出现E选择素。它们对于召集白细胞到达炎症部位具有重要作用。
E选择素存在于活化的血管内皮细胞表面。炎症组织释放的白细胞介素I(IL-1)及肿瘤坏死因子(TNF)等细胞因子可活化脉管内皮细胞,刺激E选择素的合成。
L选择素广泛存在于各种白细胞的表面,参与炎症部位白细胞的出脉管过程。白细胞表面L选择素分子上的sLeA与活化的内皮细胞表面的P选择素及E选择素之间的识别与结合,可召集血液中快速流动的白细胞在炎症部位的脉管内皮上减速滚动(即通过粘附、分离、再粘附……,如此循环往复),最后穿过血管进入炎症部位。
炎症一开始即启动白细胞的功能变化,各种选择素均使血管中白细胞的运动减慢而形成滚动状态,其中P-选择素和L-选择素在缺血-再灌注过程中的作用更大。
三、免疫球蛋白超家族
免疫球蛋白超家族(Ig-superfamily,Ig-SF)包括分子结构中含有免疫球蛋白(Ig)样结构域的所有分子,一般不依赖于Ca2+。免疫球蛋白样结构域系指借二硫键维系的两组反向平行β折叠结构。
除免疫球蛋白外,还包括T细胞受体,B细胞受体,MHC及细胞粘附分子(Ig-CAM)等。有的属于亲同性CAM,如各种神经细胞粘附分子(N-CAM)及血小板-内皮细胞粘附分子(Pe-CAM);有的属于亲异性CAM,如细胞间粘附分子(I-CAM)及脉管细胞粘附分子(V-CAM)等。I-CAM及V-CAM的配体都是整合素。
N-CAM有20余种异型分子,它们在神经发育及神经细胞间相互作用上有重要作用。
I-CAM及V-CAM在活化的血管内皮细胞表达。炎症时,活化的内皮细胞表面的I-CAM可与白细胞表面的αLβ2及巨噬细胞表面的αMβ2相结合;V-CAM则可与白细胞的α4β1整合素相结合。它们继上述选择素介导的白细胞与内皮细胞的粘合作用之后使在内皮上滚动的白细胞固着于炎症部位的脉管内皮,并发生铺展,进而分泌水解酶而穿出脉管壁。
四、整合素
整合素(integrin)大多为亲异性细胞粘附分子,其作用依赖于Ca2+。介导细胞与细胞间的相互作用及细胞与细胞外基质间的相互作用。几乎所有动植物细胞均表达整合素。
整合素是由α (120~185kD)和β(90~110kD)两个亚单位形成的异二聚体。迄今已发现16种α亚单位和9种β亚单位。它们按不同的组合构成20余种整合素。
α亚单位的N端有结合二价阳离子的结构域,胞质区近膜处都有一个非常保守的KXGFFKR序列,与整合素活性的调节有关。
含β1亚单位的整合素主要介导细胞与细胞外基质成分之间的粘附。含β2亚单位的整合素主要存在于各种白细胞表面,介导细胞间的相互作用。β3亚单位的整合素主要存在于血小板表面,介导血小板的聚集,并参与血栓形成。除β4可与肌动蛋白及其相关蛋白质结合,α6β4整合素以层粘连蛋白为配体,参与形成半桥粒。
按β亚单位分类可分β1、β2、β3 3个亚家族。
β1亚家族称为VLA(very late activation antigen)家族,含有VLA-1~6 6种整合素。VLA-1、2作为T细胞的后期活性化抗原而先被认定。而后的VLA-3、4、5、6因有同样的β链故称VLA-3、4、5、6。而实际上特别是VLA-4、5在静止期的淋巴细胞中最高。
β2亚家族也称CD18抗原,因白细胞上均有1个或多个β2整合素故称白细胞整合素(leukocyte integrin)。包括3类糖蛋白:①淋巴细胞功能相关抗原-1(LFA-1):即CDⅡa/CD18,是白细胞上的粘附受体,参与白细胞与内皮细胞的粘附过程,能识别ICAMs。LFA-1与ICAMs的粘附受细胞激动的调节,参与中性白细胞、单核细胞和淋巴细胞向血管内皮的粘附。LFA-1还参与细胞毒性细胞与其靶细胞、NK细胞与其靶细胞的相互作用。②巨噬细胞分化抗原-1(Mac-1):Mac-1(CR3、CD11b/CD18)能与补体蛋白C3bi相作用,能识别纤维蛋白原和内皮细胞上1个尚未被鉴定的配子X及几种微生物抗原。③p150.95(CD11c/CD18):其配体特异性还不清楚,但知其可参与细胞与内皮和细胞与表面结合的纤维蛋白原的相互作用。如缺乏可造成白细胞与内皮细胞粘附障碍,病人往往发生反复感染,严重者可发生致命性的难以控制的败血症而死亡[8]。
β3亚家族称为细胞粘附素(cytoadhesion),含人玻璃粘蛋白受体(VNR)和血小板的gpⅡb/Ⅲa。
细胞粘附素按功能分类可分为2类:①存在于淋巴细胞上,通过与Ig家族中的CAM结合而介导异型性细胞间的粘附。②作为各种ECM的配体,介导细胞与ECM的粘附,从而控制细胞与基膜的结合,以及细胞的游走。如在整合素β1和β3亚家族就有LN、CL、FN、FB、VN等ECM受体的机能。
五、透明质酸粘素
透明质酸粘素(hyaladherin)包括可结合透明质酸糖链的一类分子,具有相似的氨基酸序列和空间构象。CD44族是其中的一个成员,分子量范围为85 KD~250KD,介导细胞与细胞间及细胞与细胞外基质间的相互作用,同样是由胞外,跨膜及胞质三个部分构成的糖蛋白,糖链为硫酸软骨素及硫酸乙酰肝素。CD44肽链的N端可结合透明质酸,故CD44也被视为透明质酸的受体。
CD44的功能包括: ①与透明质酸、纤粘连蛋白及胶原结合,介导细胞与细胞外基质之间的粘附;②参与细胞对透明质酸的摄取及降解;③参与淋巴细胞归巢;④参与T细胞的活化;⑤促进细胞迁移。
CD44在很多种肿瘤细胞的表达比相应正常组织为高,并与肿瘤细胞的成瘤性、侵袭性及淋巴结转移性有关。
细胞粘附分子的研究及发展
CAM群的发展:CAM曾指层粘连蛋白(LN)和纤维粘连蛋白(FN)等构成细胞外基质(ECM)的蛋白质。近来CAM才被明确认为是一群分子家族。特别是ECM受体群的发现,揭示了CAM是数目繁多的大家族。因CAM范畴的分子在体外培养中均显示出细胞的粘附活性,故称CAM。但其在体内的作用机制还不完全明确。
CAM的研究方向:CAM在细胞间的连接方式是研究之一。同种细胞间以同种CAM连接称同种连接,细胞间以异种CAM连接称异种连接。同种连接中有名的是神经细胞粘附分子(NCAM)和钙依赖性粘附素(adhenin),其他的连接方式多是异种连接。
CAM生理作用是研究之二。细胞粘附是细胞维持形态结构与功能的生物现象。以前CAM多指细胞膜上的跨膜蛋白,如thy-1和LFA-3。现认为CAM并不是单纯结构性的起连接作用,而是通过细胞间的机械性连接来识别外界,或是将外界的信息传达到细胞内。如跨膜蛋白中含有浓缩的酪氨酸激酶,说明CAM间有信息传递的功能。
近年通过单克隆技术已鉴定出多种与细胞粘附有关的CAM,已知的CAM可分5个超级家族。随着不断研究将有更多的CAM被鉴定和阐明。
细胞粘附分子表达数量改变对粘附作用的调节
粘附分子表达数量的改变是粘附作用调节的另一个重要方面。粘附分子构型改变与表达数量的增减并不是截然分开的两个过程,两者可能同时存在,共同完成对粘附作用的调节。如淋巴细胞活化后不仅粘附分子构型改变导致亲和力增加,同时也伴有粘附分子数量的增加。
1. 调节细胞表面粘附分子表达数量的方式
细胞表面粘附分子表达数量的调节方式主要有诱导贮存在细胞内的粘附分子转移到细胞表面和诱导粘附分子的重新合成两种方式。转移形式的过程发生迅速,只需数秒钟,但维持时间短暂。如凝血酶和组胺作用于内皮细胞可以诱导内皮细胞内贮存的CD62分子迅速转移到细胞表面,然后又很快被内吞而消失; 又如CD11b/CD18、CD11c/CD18贮存在中性粒细胞的胞浆颗粒内,在PMA、TNF、IL-1刺激后迅速转移到细胞表面。重新合成过程发生较为迟缓,一般需数小时,但维持时间较长。IL-1、TNF-α作用于血管内皮细胞则可以诱导E-selectin、VCAM-1分子的重新合成与表达, 诱导后4小时达到高峰,并可维持24小时以上。
2. 细胞因子、炎症介质对粘附分子表达的调节
细胞因子IL-1、IL-3、IL-4、IL-8、PAF、GM-CSF、TNF-α、TNF-β和IFN-γ以及炎症介质白三烯、组胺和凝血酶等可作用于白细胞或/和血管内皮细胞, 调节白细胞与血管内皮细胞的粘附作用(表2-6)。在体内可能有多种调节因素同时存在,相互影响,并可能有更多的目前未知的因素参与细胞间粘附的调节过程。
3. 细胞的生长、发育状态对粘附分子表达的影响
除了上述细胞因子、炎症介质可以调节细胞粘附分子的表达外,细胞本身的生长、发育、分化及代谢状态也可以影响粘附分子的表达。在胚胎发育过程中,组织细胞粘附分子的表达按一定的规律发生改变,使得不同细胞得以按一定的规律组合在一起,形成不同的组织或器官。肿瘤细胞与其起源的正常组织细胞相比其表达的粘附分子可有很大差异,这可能是某些肿瘤细胞易发生浸润、转移等现象的分子基础。此外,处于不同分化和发育状态的淋巴细胞表达粘附分子也有明显改变,如与未经抗原刺激的T细胞(naive T cell)相比,记忆性T细胞(memory T cell)表达更多的CD2、LFA-1、CD44、VLA-4等粘附分子,而L-selectin在naive T细胞表达水平要明显高于记忆T细胞。
| 关于“细胞粘附分子”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |