甲酸
| A+医学百科 >> 甲酸 |
| 甲酸 | |||
|---|---|---|---|
|
|
|||
| IUPAC名 Formic acid, Methanoic acid |
|||
| 别名 | HCOOH | ||
| 识别 | |||
| CAS号 | 64-18-6 | ||
| SMILES |
|
||
| RTECS | LQ4900000 | ||
| 性质 | |||
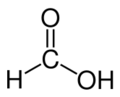
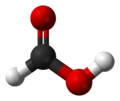
| 化学式 | CH2O2 HCOOH |
||
| 摩尔质量 | 46.0254 g·mol⁻¹ | ||
| 外观 | 无色发烟液体 | ||
| 密度 | 1.22 g/mL (液) | ||
| 熔点 | 8.4 °C (47.1 °F) | ||
| 沸点 | 100.8 °C (213.3 °F) | ||
| 溶解性(水) | 混溶 | ||
| pKa | 3.744 | ||
| 黏度 | 1.57 cP, 26 °C | ||
| 结构 | |||
| 分子构型 | 平面 | ||
| 偶极矩 | 1.41 D (气态) | ||
| 危险性 | |||
| 警示术语 | R:R10-R35 | ||
| 安全术语 | S:S1/2-S23-S26-S45 | ||
| MSDS | ScienceLab.com | ||
| 主要危害 | 腐蚀性、刺激性 | ||
| NFPA 704 | |||
| 闪点 | 69 °C (156 °F) | ||
| 相关物质 | |||
| 相关羧酸 | 乙酸、丙酸 | ||
| 相关化学品 | 甲醛、甲醇 | ||
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |||
甲酸(英文:Formic acid)又称作蚁酸,化学式为HCOOH。蚂蚁分泌物和蜜蜂的分泌液中含有蚁酸,当初人们蒸馏蚂蚁时制得蚁酸,故有此名。甲酸无色而有刺激气味,且有腐蚀性,人类皮肤接触后会起泡红肿。熔点8.4℃,沸点 100.8℃。由于甲酸的结构特殊,它的一个氢原子和羧基直接相连。也可看做是一个羟基甲醛。因此甲酸同时具有酸和醛的性质。在化学工业中,甲酸被用于橡胶、医药、染料、皮革种类工业。
目录 |
性质
甲酸与水和大多数的极性有机溶剂混溶,在烃中也有一定的溶解性。在烃中及气态下, 甲酸以通过以氢键结合的二聚体形态出现。在气态下,氢键导致甲酸气体与理想气体状态方程之间存在较大的偏差。液态和固态的甲酸由连续不断的通过氢键结合的甲酸分子组成。
甲酸具有与大多数其他羧酸相同的性质,尽管在通常情况下甲酸不会生成酰氯或者酸酐。直到不久以前,所有试图将甲酸转化成这些衍生物的尝试都以产物一氧化碳告终。甲酸酐可由甲酰氟和甲酸钠在零下78摄氏度反应得到。甲酰氯可由将氯化氢气体通过零下60度1-甲酰基咪唑的一氯甲烷溶液得到。甲酸脱水分解为一氧化碳和水。甲酸具有和醛类似的还原性。它能起银镜反应,把银氨络离子中的银离子还原成金属银,而自己被氧化成二氧化碳和水:
HCOOH+2AgOH→2Ag+2H2O+CO2
甲酸是唯一能和烯烃进行加成反应的羧酸。甲酸在酸的作用下(如硫酸,氢氟酸),和烯烃迅速反应生成甲酸酯。但是类似于Koch反应的副反应也会发生,产物是更高级的羧酸。
大多数的甲酸盐溶于水。
制备
制备其他化学药品(尤其是乙酸)的过程中,大量的甲酸作为副产物被生产出来。 然而这样的制备远远的不能满足目前对甲酸的需要,所以有些甲酸被直接生产。
- CH3OH + CO → HCOOCH3
在工业生产中, 此反应在液态和加压的状态下进行。 典型的反应条件为80摄氏度和40个大气压。广泛使用的碱为甲醇钠。水解甲酸甲酯得到甲酸。
- HCOOCH3 + H2O → HCOOH + CH3OH
水解甲酸甲酯需要大量的水来保证反应顺利进行。 有些生产商使用一种间接的水解途径, 即先将甲酸甲酯和氨反应产生甲酰胺,然后用硫酸水解甲酰胺得到甲酸:
- HCOOCH3 + NH3 → HCONH2 + CH3OH
- 2HCONH2 + 2H2O + H2SO4 → 2HCOOH + (NH4)2SO4
这种技术有其自身缺点,尤其是在对副产物硫酸铵的处理上。有些生产商最近发展了一类节能的方法,即将甲酸从直接水解的大量水溶液中提取出来。在其中一种方法(由巴斯夫所使用)中,甲酸在有机碱的作用下由湿法萃取得到。
在实验室制备中,甲酸可由在无水丙三醇中加热草酸,然后蒸汽蒸馏得到。另外一种制备方法(必须要在通风橱中进行)是在盐酸作用下的异乙腈的水解。
- C2H5NC + 2H2O → C2H5NH2 + HCOOH
异腈的制备由乙胺和氯仿反应获得。(异腈过于令人不快的气味使此反应必须在通风橱中进行。)
安全
化学性质
甲酸具有羧酸的通性。但甲酸同时具有一个醛基,这使它可以被进一步氧化:
- 2HCOOH + O2 → 2CO2 + 2H2O
甲酸在浓硫酸或氧化铝催化下加热脱水生成一氧化碳,这是实验室制取纯净一氧化碳的方法。
- HCOOH → CO + H2O (在浓硫酸催化下加热)
- HCOOH → CO2 + H2
参见
参考资料
参考来源
| 关于“甲酸”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |