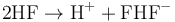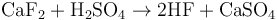氢氟酸
| A+医学百科 >> 氢氟酸 |
| 氢氟酸 | |
|---|---|
 |
|
| IUPAC名 Hydrofluoric acid |
|
| 别名 | 氟化氢 |
| 识别 | |
| CAS号 | 7664-39-3 |
| RTECS | MW7875000 |
| 性质 | |
| 化学式 | HF |
| 外观 | 无色溶液 |
| 密度 | 1.15 g/mL (浓度为48%的氢氟酸) |
| pKa | 3.18 |
| 危险性 | |
| 警示术语 | R:R26/27/28-R35-R37 |
| 安全术语 | S:S1/2-S7/9-S26-S36/37-S45 |
| MSDS | duPont MSDS |
| NFPA 704 | |
| 闪点 | 不可燃 |
| 相关物质 | |
| 其他阴离子 | 氯化氢 溴化氢 碘化氢 |
| 其他阳离子 | 氟化钠 |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
氢氟酸是氟化氢的水溶液,具有强烈的腐蚀性,纯氟化氢有时也称作无水氢氟酸。因为氢原子和氟原子间结合的能力相对较强,使得氢氟酸在水中不能完全电离,所以理论上低浓度的氢氟酸是一种弱酸,但是氢氟酸却能够溶解很多其他酸都不能溶解的玻璃(二氧化硅)。[1] 反应方程式如下:
以上反应分两步进行:
SiF4易溶于水,与HF继续反应:
正因如此,它必须储存在塑料容器中(放在聚四氟乙烯容器中最好)[1]。如果要长期储存,不仅需要密封容器,而且容器应尽可能真空,因为氢氟酸能够溶解绝大多数无机氧化物。高浓度的氢氟酸是强酸,原因是发生了如下反应:
目录 |
生产
实验室中用萤石(氟化钙 CaF2)和浓硫酸来制造氢氟酸。[1]
加热到250摄氏度时,这两种物质便反应生成氟化氢。反应方程式为:
这个反应生成的蒸气是氟化氢、硫酸和其他几种副产品的混合物。在此之后氟化氢可以通过蒸馏来提纯。工业上的氢氟酸是通过用酸分解磷灰石获得的。
汽车发动机产生的气体中也有氟化氢。这是某些种类橡胶做的皮圈和软管在400℃下反应生成的。
用途
由于氢氟酸溶解氧化物的能力,它在铝和铀的提纯中起着重要作用。[1]氢氟酸也用来蚀刻玻璃,半导体工业使用它来除去硅表面的氧化物,在炼油厂中它可以用作异丁烷和丁烷的烷基化反应的催化剂,除去不锈钢表面的含氧杂质的“浸酸”过程中也会用到氢氟酸。[1]
氢氟酸也用于多种含氟有机物的合成,比如特氟隆(聚四氟乙烯),还有氟利昂一类的致冷剂。[1]
安全性
在人体内部,氢氟酸与钙离子和镁离子反应,正因为如此,它会使依靠以上两种离子发挥机能的器官丧失作用。接触、暴露在氢氟酸中一开始可能并不会疼痛,而征状可能直到几小时后氢氟酸与骨骼中的钙反应时才会出现。如果不进行处理,最终可能导致心、肝、肾和神经系统的严重甚至是致命损伤。[2][3]
接触氢氟酸后的初始救护措施通常包括在接触部位涂上葡萄糖酸钙凝胶。如果接触范围过广,又或者延误时间太长的话,医护人员可能会在动脉或周围组织中注射钙盐溶液。但无论如何,接触氢氟酸后必须得到及时并且专业的护理。[2][3]
即使能得到及时治疗,身体表面少于10%的面积暴露在氢氟酸中也会是致命的。(身体少于2%的面积暴露在氢氟酸中也有可能是致命的。)吞服高浓度的氢氟酸溶液会导致急性的低血钙症,引致心脏停搏及死亡。[2][3]
参考文献
参见
参考来源
| 关于“氢氟酸”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |

![\rm SiO_2+6 HF\rightarrow H_2[SiF_6]+2 H_2O\,](/images/math/c/9/b/c9b47ea29920525168bd1aedad03ff17.png)
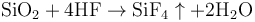
![\rm SiF_4+2 HF\rightarrow H_2[SiF_6]\,](/images/math/9/5/e/95ed99baab1a751840231f2711137d59.png)