生理学/化学门控通道
| 医学电子书 >> 《生理学》 >> 细胞的基本功能 >> 细胞的跨膜信号传递功能 >> 由具有特异感受结构的通道蛋白质完成的跨膜信号传递 >> 化学门控通道 |
| 生理学 |
|
|
对这种跨膜信号的传递方式的研究,最早是从对运动神经纤维末梢释放的乙酰胆碱(Ach)如何引起它所支配的骨骼肌细胞兴奋的研究开始的。早已知道,当神经冲动到达神经末梢处时,先是由末梢释放一定数量的Ach分子,后者再同肌细胞膜上称为终板(指有细胞膜上同神经末相对的那部分膜,其中所含膜蛋白与一般肌细胞膜不同)处的“受体”相结合,引起终板膜产生电变化,最后引起整个肌细胞的兴奋和收缩。由于神经-肌接头处的“受体”也可同烟碱相结合,因而过去在药理学分类中称它为N-型Ach受体。80年代后期,我国学者李镇源发现α-银环蛇毒同N-型受体有极高的特异性结合能力又有人发现一些电鱼的电器官中有密集的这种受体蛋白质分子存在;再依靠70年代以来蛋白质化学和分子生物学技术的迅速发展,目前不仅已将这种蛋白质分子提纯,而且基本上搞清了它的分子结构和它们在膜中的存在形式。原来它是由4种不同的亚单位组成的5聚体蛋白质(图2-7),总分子量约为290kd;每种亚单位都由一种mRNA编码,所生成的亚单位在膜结构中通过氢键等非共价键式的相互吸引,形成一个结构为α2βγδ的梅花状通道样结构(图2-7,A和B),而其中的两个α-亚单位正是同两分子ACH相结合的部位,这种结合可引起通道结构的开放,其几何大小足以使终板膜外高浓度的Na+内流,同时也能使膜内高浓度的K+外流结果是使原来存在两侧的静息电位近于消失,亦即使该处膜内外电位差接近于0值,这就是终板电位,于是完成了Ach这种化学信号的跨膜传递,因为肌细胞后来出现的兴奋和收缩都是以终板电位为起因的。
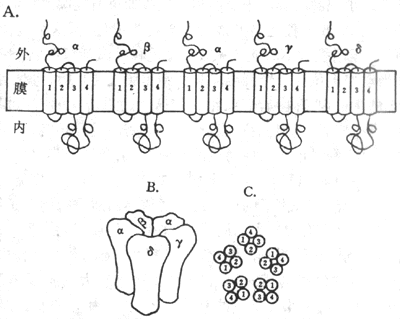
图2-7 N-型Ach门控通道的分子结构示意图
A:N-型Ach门控通的5个亚单位和它们所含α-螺旋在膜中存在形式的平面示意图
B:5个亚单位相互吸引,包绕成一个通道样结构 C:在跨膜通道结构中,各
个亚单位亿含α-螺旋在通道结构中的位置
用分子生物学实验技术证明,同其他膜结合蛋白质类似,在上述4种不同的亚单位肽链中,都存在有4种主要由20-25个疏水性氨基酸形成的α-螺旋,因而推测每个亚单位的肽链都要反复贯穿膜4次(图2-7,A),而5个亚单位又各以其第2个疏水性跨膜α-螺旋构成了水相孔道的“内壁”(图2-7C)。
由上述分子水平的研究成果可以知道,原初将终板膜上完成Ach跨膜信号传递的蛋白质称作“受体”是不符合实际情况的;它们是一种通道样结构,只是在组成通道的蛋白质亚单位中有两个亚单位具有同Ach分子特异地相结合的能力,并能因此引起通道蛋白质的变构作用而使通道开放,然后靠相应离子的易化扩散而完成跨膜信号传递。因此,这种蛋白质应称为N-型(或烟碱型)Ach门控通道,属于化学门控通道或化学依从性通道中的一种。
Ach在神经-肌接头处的跨膜信号传递机制的阐明,曾一度错误地推测,其他一些神经递质也都是以类似的方式作用于下一级神经元或相应的效应器细胞的;但后来的研究表明并非如此。目前只证明了一些氨基酸递质,包括谷氨酸、门冬氨酸、γ-氨基丁酸和甘氨酸等,主要是通过同N-型Ach门控通道结构类似的化学门控通道影响其靶细胞。
参看
| 关于“生理学/化学门控通道”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |