硝酸
| A+医学百科 >> 硝酸 |
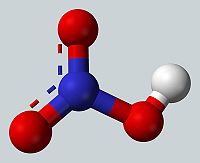
硝酸(nitric acid)分子式HNO₃,是一种有强氧化性、强腐蚀性的无机酸,酸酐为五氧化二氮。硝酸的酸性较硫酸和盐酸小(PKa=-1.3),易溶于水,在水中完全电离,常温下其稀溶液无色透明,浓溶液显棕色。硝酸不稳定,易见光分解,应在棕色瓶中于阴暗处避光保存,严禁与还原剂接触。硝酸在工业上主要以氨氧化法生产,用以制造化肥、炸药、硝酸盐等,在有机化学中,浓硝酸与浓硫酸的混合液是重要的硝化试剂。
目录 |
历史
世界史
公元八世纪,阿拉伯炼金术士贾比尔.伊本.哈扬(Jabir ibn Hayyan)在干馏硝石的时候发现并制得了硝酸,这是人类关于硝酸最早的记录。同时,他也是硫酸和王水的发现者。
1905年,挪威出现了电弧法生产硝酸的工厂,这是历史上最早的硝酸工业化尝试;
1908年,德国建成了以铂网为催化剂的日产能力3吨的硝酸厂
1913年,合成氨问世,氨氧化法生产硝酸开始进入工业化阶段,至今依然是世界上生产硝酸的主要方法。
中国史
1935年,在中国化学家侯德榜的领导下,中国建成了第一座兼产合成氨、硝酸、硫酸和硫酸铵的联合企业-永利宁厂(现南京化学工业公司);
1937年2月,永利宁厂第一次生产出优质的硝酸,但开工不到半年就遇上日本发动侵华战争。由于硝酸与国防工业密切相关,日方多次威逼永利宁厂合作,均遭侯德榜拒绝,因此工厂遭日机轰炸而停产。
1945年8月日本投降后,硝酸生产逐渐恢复,但仍然处于十分落后的状态,在1949年,我国的硝酸生产企业只有两家:永利宁厂和大连化学厂(现大连化学工业公司),年产量仅4200吨;
1951年5月,大连化学厂的炼焦、合成氨、硝酸和硫酸等车间的生产得到了全面的恢复,产出了硝酸产品。
1952~1958年间,我国先后在吉林、兰州、太原等地建成了综合法硝酸装置,其中兰州化学工业公司的浓硝酸在1997年前的几十年里一直蝉联着我国最大装置的桂冠;
1980年起,中国国内硝酸产业的发展开始加速,总产量每年以10%~15%的速度增长。特别是90年代后期,中国的硝酸工业进入蓬勃发展时期,总产量年增速达到了15%~20%。但这个时期中国硝酸生产技术仍然比较落后,早期的常压法、综合法工艺装置多为淘汰型生产线,高压法装置全部靠进口国外的二手设备。不久,山西化肥厂(现天脊集团)从国外引进了中国第一套双加压硝酸装置,从此中国的硝酸工业开始向国际先进行列迈进。
1999年,西安陕鼓动力股份有限公司成功研制出我国第一套“四合一”机组,并应用于云南云峰化学工业公司,从此加快了中国硝酸双加压工艺国产装备向国际先进水平进军的步伐。云南云峰化学工业公司作为第一个使用国产化“四合一”机组的硝酸生产企业,坚定了中国国内硝酸生产企业选择国产装备的信心;
2000年后,中国的硝酸工业进入高速发展期,年总产量以高于18%的速度快速增长,拥有各种种类、规模不等的生产厂家约60多家;
2007年11月,中国第一套在满负荷生产条件下实现副产蒸汽自足、还能富余外供蒸汽的国产化双加压法硝酸装置在新乡市永昌化工有限责任公司诞生,标志着中国自己研制的国产硝酸装置完全能够替代进口,中国国内硝酸工业摆脱了对进口装备的依赖。
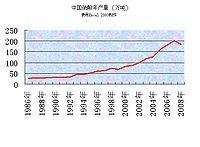
中国浓硝酸生产历年增长情况
由下表数据(产量)所绘折线图见右
| 年 份 | 产 量 (万吨) | 年增长量 (万吨) | 年增长率 (%) |
| 1986年 | 27.5 | ||
| 1987年 | 29.0 | 1.5 | 5.45 |
| 1988年 | 30.2 | 1.2 | 4.14 |
| 1989年 | 31.7 | 1.5 | 4.97 |
| 1990年 | 31.8 | 0.1 | 0.32 |
| 1991年 | 31.80 | 0 | 0 |
| 1992年 | 34.31 | 2.51 | 7.89 |
| 1993年 | 46.18 | 11.87 | 34.6 |
| 1994年 | 47.18 | 1.0 | 2.17 |
| 1995年 | 51.29 | 4.11 | 8.71 |
| 1996年 | 60.39 | 9.10 | 17.74 |
| 1997年 | 62.53 | 2.14 | 3.54 |
| 1998年 | 73.21 | 10.68 | 17.08 |
| 1999年 | 68.47 | -4.74 | -6.47 |
| 2000年 | 82.48 | 14.01 | 20.46 |
| 2001年 | 87.97 | 5.49 | 6.66 |
| 2002年 | 99.12 | 11.15 | 12.67 |
| 2003年 | 118.52 | 19.40 | 19.58 |
| 2004年 | 126.46 | 7.94 | 6.70 |
| 2005年 | 161.44 | 34.98 | 27.66 |
| 2006年 | 181.78 | 20.34 | 12.60 |
| 2007年 | 200.88 | 19.10 | 10.51 |
| 2008年 | 183.76 | -17.12 | -8.52 |
存在与制备
自然界
自然界中的硝酸主要由雷雨天生成的一氧化氮形成。硝酸性质不稳定,因而无法在自然界长期存在,但硝酸的形成是氮循环的一环。自然界中硝酸的形成按如下步骤
一氧化氮的生成
N₂ (g)+ O₂(g)——→ 2NO(g)
二氧化氮的生成
N₂(g) + 2O₂(g)——→ 2NO₂ (g)
2NO(g)+ O₂(g)——→ 2NO₂ (g)
生成的二氧化氮溶于水中生成硝酸
3NO₂(g)+ H2O(l)——→ 2HNO₃(aq)+ NO(g)
工业合成
氨氧化法
硝酸工业与合成氨工业密接相关,氨氧化法是工业生产中制取硝酸的主要途径,其主要流程是将氨和空气的混合气(氧:氮≈2:1)通入灼热(760~840℃)的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮(NO)。生成的一氧化氮利用反应后残余的氧气继续氧化为二氧化氮,随后将二氧化氮通入水中制取硝酸。稀硝酸、浓硝酸、发烟硝酸的制取在工艺上各不相同。
4NH₃(g)+ 5O₂(g)—Pt-Rh→ 4NO(g)+ 6H2O(g)
2NO(g)+ O₂(g)——→ 2NO₂ (g)
3NO₂(g)+ H2O(l)——→ 2HNO₃(aq)+ NO(g)
其它
工业上也曾使用浓硫酸和硝石制硝酸,但该法耗酸量大,设备腐蚀严重,现基本停止使用
NaNO₃(s)+ H2SO₄(l) ——→ NaHSO₄(s)+ HNO₃(g)
结构
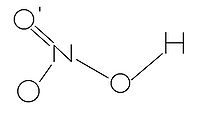
硝酸为平面共价分子,中心氮原子sp2杂化,未参与杂化的一个p轨道与周围三个氧原子形成四中心六电子的离域π键。硝酸中的羟基氢与非羟化的氧原子形成分子内氢键,这是硝酸酸性不及硫酸、盐酸熔沸点较低的主要原因。硝酸分子的键长、键角数据见下及右图。
键长
O-N:119.9pm
O'-N:121.1pm
O-H:96.4pm
N-OH:140.6pm
键角
O'-N-O:130.27°
O-N-OH:113.85°
O'-N-OH:115.88°
N-O-H:102.2°
性质
物理性质
纯净的硝酸是无色透明液体,工业品浓硝酸和发烟硝酸因溶有二氧化氮而显棕色。硝酸易溶于水,101.32 kPa下,当其质量分数达到68%(约15mol/L)时形成共沸混合物(沸点120.5℃),此后硝酸质量分数不增加,制取更浓的硝酸需要对硝酸脱水生成超共沸混合物并进行蒸馏。
硝酸的其它参数见下:
| CAS号 | 7697-37-2 |
| RTECS号 | QU5775000 |
| 化学式 | HNO₃ |
| 摩尔质量 | 63.012 g mol |
| 密度 | 1.51 g/cm3 |
| 熔点(℃) | -42 |
| 沸点(℃) | 纯酸:83 68%溶液:120.5 |
| 溶解度 | 易溶 |
| 偶极矩 | 2.17±0.02D |
| EU分类 | 氧化性 (O) 腐蚀性 (C) |
| 警示性质标准词 | R8, R35 |
| 安全建议标准词 | S1/2, S23, S26, S36, S45 |
注:所有数据都依从国际单位制,以及标准状况(25 ℃、100 kPa)
化学性质
酯化反应(esterification)
硝酸可以与醇发生酯化反应生成对应的硝酸酯,在机理上,硝酸参与的酯化反应过去被认为生成了碳正离子中间体,但现在许多文献将机理描述为费歇尔酯化反应(Fischer esterification),即“酸脱羟基醇脱氢”与羧酸的酯化机理相同。
硝酸的酯化反应被用来生产硝化纤维,方程式见下
3nHNO₃+ [C6H7O2(OH)3]n ——→ [C6H7O2(O-NO2)3]n + 3nH2O
硝化反应(nitration)
浓硝酸或发烟硝酸与脱水剂(浓硫酸、五氧化二磷)混合可作为硝化试剂对一些化合物引发硝化反应,硝化反应属于亲电取代反应(electrophilic substitution),反应中的亲电试剂为硝鎓离子,脱水剂有利于硝鎓离子的产生。
最为常见的硝化反应是苯的硝化:Ph-H + HO-NO₂ ——→ Ph-NO₂ + H2O
氧化还原反应(reduction-oxidation reaction)
硝酸分子中氮元素为最高价态(+5)因此硝酸具有强氧化性,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为二氧化氮,稀硝酸主要为一氧化氮,更稀的硝酸可以被还原为一氧化二氮、氮气、硝酸铵等,需要指出,上述只是优势产物,实际上随着反应的进行,硝酸浓度逐渐降低,所有还原产物都可能出现。
硝酸有关电势图见下(标况 E/V)
HNO₃ —0.798.9→ NO₂ —1.08→ HNO₂ —1.04→ NO —1.582→ N2O —1.77→ N₂ —0.27→ NH+₄
HNO₃—0.97→ NO
HNO₃—1.25→ N2O
HNO₃—0.88→ N₂
以下提供一些典型反应
浓硝酸:
Cu(s)+ 4HNO₃(aq)——→ Cu(NO3)₂(aq)+ 2NO₂(g)+ 2H2O(l)
P(s)+ 5HNO₃(aq)——→ H3PO₄(aq)+ 5NO₂(g)+ H2O(l)
稀硝酸:
3Cu(s)+ 8HNO₃(aq)——→ 3Cu(NO3)₂(aq)+ 2NO(g)+ 4H2O(l)
Fe(s)+ 4HNO₃(aq)——→ Fe(NO3)₃(aq)+ NO(g)+ 2H2O(l)
3Zn(s)+ 8HNO₃(aq)——→ 3Zn(NO3)₂(aq)+ 2NO(g)+ 4H2O(l)
4Zn(s)+ 10HNO₃(aq)——→ 4Zn(NO3)₂(aq)+ N2O(g)+ 5H2O(l)
4Zn(s)+ 10HNO₃(aq)——→ 4Zn(NO3)₂(aq)+ NH4NO₃(aq)+ 3H2O(l)
6KI(aq)+ 8HNO₃(aq)——→ 6KNO₃(aq)+ 3I₂(s)+ 2NO(g)+ 4H2O(l)
应用
作为硝酸盐和硝酸酯的必需原料,硝酸被用来制取一系列硝酸盐类氮肥,如硝酸铵、硝酸钾等;也用来制取硝酸酯类或含硝基的炸药。
由于硝酸同时具有氧化性和酸性,硝酸也被用来精炼金属:即先把不纯的金属氧化成硝酸盐,排除杂质后再还原。硝酸能使铁钝化而不致继续被腐蚀。还可供制氮肥、王水、硝酸盐、硝化甘油、硝化纤维素、硝基苯、苦味酸等.
将甘油放和浓硝酸、浓硫酸中,会生成硝化甘油。这是一种无色或黄色的透明油状液体,是一种很不稳定的物质,受到撞击会发生分解,产生高温,同时生成大量气体。气体体积骤然膨胀,产生猛烈爆炸。所以硝化甘油是一种烈性炸药。
硝化炸药军事上用得比较多的是2,4,6-三硝基甲苯(TNT)。它是由甲苯与浓硝酸和浓硫酸反应制得的,是一种黄色片状物,具有爆炸威力大、药性稳定、吸湿性小等优点,常用做炮弹、手榴弹、地雷和鱼雷等的炸药,也可用于采矿等爆破作业。
包装与储运
铁路槽车装载50吨,其中铅槽车用以输送98%浓硝酸,稀硝酸应用不锈钢或玻璃钢增强塑料槽车或储罐输送或储存。少量采用耐酸陶瓷坛或玻璃瓶包装,每坛净重33~40kg。浓硝酸采用耐酸泥封口,稀硝酸采用石膏封口。每坛装入衬有细煤渣或细矿渣等物的坚固木箱中,以便运输。包装上应有明显的“腐蚀性物品”标志。因铝的表面有一层氧化膜,起了钝化作用,而且经济,所以铝是硝酸理想的容器。个体防护禁止皮肤直接接触,作业操作时应带耐酸碱手套,口罩,以及其他劳保用品。
皮肤接触:马上用大量清水冲洗,再用0.01%苏打水(或稀氨水)浸泡;
误食:催吐,用牛奶或蛋清。
实验室里的浓硝酸必须保存在带玻璃塞的棕色瓶子里,贮放在阴暗处。
参见
硝酸溶液
.稀硝酸
.浓硝酸
.发烟硝酸
其它
.亚硝酸
.连二硝酸
.过氧硝酸
.硝基化合物
.硝酸盐
| 关于“硝酸”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |