医用化学/高分子化合物溶液
| 医学电子书 >> 《医用化学》 >> 胶体溶液 >> 高分子化合物溶液 |
| 医用化学 |
|
|
一、高分子化合物的概念
在自然界中,存在着大量高分子化合物。随着科学技术的发展,人们又合成了大量的高分子化合物。它们的共同特点是都具有很大的相对分子质量。如生物体中的蛋白质、核酸、糖原、淀粉、纤维等都是高分子化合物。它们是由许多重复的原子团或分子残基所组成,这些较小的原子团或分子残基叫做单体。如淀粉分子是由成千上万个葡萄糖分子残基按一定方式联结而成的。天然橡胶分子是由许多异戊二烯(CH2=C(CH3)-CH=CH2)的单体联结而成的大分子。
高分子化合物是大分子,其粒子的形状是复杂的。不同高分子化合物,在溶液中分子的形状往往也有很大的差异。例如,γ-球蛋白的分子是球形分子,脱氧核糖核酸分子是线形分子。线形分子在不同条件下形状有时也不一样,有的是比较伸展的线条形,有的则是卷曲的无规则线团。由于分子形状不同,它们在运动中的相互干扰作用也不一样。球形分子互相干扰少,而线形分子则互相干扰大,因此线形分子的粘度就大。
高分子化合物粒子具有许多亲溶剂基团,质点表面结合着一层溶剂。溶剂化后的粒子在溶液中成为一个运动单体,降低了运动速度,影响了溶液的粘度。
当高分子化合物为电解质时,粒子带有电荷。例如蛋白质类高分子化合物,由于含有酸性基团(-COOH)和碱性基团(-NH2),在水溶液中,因溶液PH值的差异,蛋白质大分子可以带正电荷或负电荷。
大分子的这些特性,往往影响到高分子化合物溶液的性质。
二、高分子化合物溶液的性质
高分子化合物溶液中,溶质和溶剂有较强的亲和力,两者之间有没有界面存在,属均相分散系。由于在高分子溶液中,分散质粒子已进入胶体范围(1-100nm),因此,高分子化合物溶液也被列入胶体体系。它具有胶体体系的某些性质,如扩散速度小,分散质粒子不能透过半透膜等,但同时也具有自己的特征。
(一)稳定性
高分子化合物溶液属均相分散系,可长期放置而不沉淀。在稳定性方面它与真溶液相似。
另外,由于高分子化合物具有许多亲水基团(如-OH,-COOH,-NH2等),当其溶解在水中时,其亲水基团与水分子结合,在高分子化合物表面形成了一层水化膜,使分散质粒子不易靠近,增加了体系的稳定性。
(二)粘度
液体的一部分流过其他一部分所受到的阻力叫粘度。高分子化合物溶液的粘度比一般溶液或溶胶大得多,高分子化合物溶液的高粘度与它的特殊结构有关。
高分子化合物常形成线形、枝状或网状结构,这种伸展着的大分子在溶剂中的行动困难,枝状、网状结构牵制溶剂,使部分液体失去流动性,自由液体量减少,故表现为高粘度。由于粘度与粒子的大小、形状及溶剂化程度直接相关,所以测定蛋白质溶液的粘度就能推知蛋白质分子的形状和大小。
(三)盐析
盐析作用在高分子化合物溶液中,加入足够量的中性盐时,可使高分子化合物从溶液中析出,这就是盐析作用。使一升溶液出现盐析现象所需中性盐的最小量称盐析浓度,单位为mol.L-1。盐析浓度一般都比较大,如血浆中各种蛋白质盐析所需的盐一般不少于1.3-2.5mol.L-1。
盐析效应的特点是,同价同符号的不同离子,对盐析效应的能力不一样。
已发现各种盐的盐析能力,其阴离子的能力有如下次序:
1/2SO42->OAc->CL->NO2->Br->I->CNS-
其阳离子则有如下次序:
盐析作用的实质,主要是高分子化合物与溶剂(水)间的相互作用被破坏,盐的加入使高分子化合物分子脱溶剂化。盐的加入还使一部分溶剂(水)与它们形成溶剂(水)化离子,致使这部分溶剂(水)失去溶解高分子化合物的性能。溶剂(水)被电解质夺去,高分子化合物沉淀析出。所以盐类的水化作用越强,其盐析作用也越强。上述离子盐析能力顺序,实质上反映了离子水化程度大小的次序。
分段盐析盐析时,相对分子质量大的蛋白质比相对分子质量小的蛋白质更容易沉淀。利用这一原理可以用不同浓度的盐溶液使蛋白质分段析出加以分离。例如,(NH4)2SO4使血清中球蛋白盐析的浓度是2.0mol.L-1,清蛋白盐析浓度是3-35mol.L-1。在血清中加(NH4)2SO4达一定量,则球蛋白先析出,滤去球蛋白,再加(NH4)2SO4则可使清蛋白析出,这个过程叫分段盐析。
(四)高分子化合物溶液的保护作用
在溶胶中加入适量高分子化合物溶液,可以显著的增加溶胶的稳定性,这种现象叫保护作用。在制备银溶胶的过程中,加入蛋白质所得的胶体银(称为蛋白银),较普通银溶胶稳定。将所得蛋白银蒸干后能重新溶于水。蛋白银比普通银溶胶浓度更高,银粒更细,它含胶体银8.5%-20%,是极强的防腐剂。当保护蛋白质减少时,这些微溶性盐就要沉淀,因而形成结石。
一般认为高分子化合物保护作用的机理是,高分子化合物的大分子为溶胶胶粒所吸附,并在胶粒表面形成保护膜,因而大大削弱了胶粒聚结的可能性。
(五)膜平衡
当用半透膜将高分子电解质(R-Na+)溶液和低分子电解质(Na+CL-)溶液隔开,其中高分子离子(R-)不能透过半透膜,其它低分子离子(Na+、CL-等)都能自由透过半透膜,结果会有一定量低分子电解质离子透过膜进入高分子电解质溶液中,当小离子透过速度相等,并保持膜两侧电中性时,即达平衡状态,这时所发生的平衡现象叫膜平衡或董南(Donnan)平衡。
设高分子电解质溶液的浓度为c1,NaCL溶液的浓度为c2,设膜内外的体积相等。
因为膜内没有CL-,扩散结果使 一部分CL-通过半透膜进入膜内,设达到平衡时进入膜内的CL-浓度为x,根据整个溶液保持电中性原则,就必须有相等数目(x)的Na+同CL-一道进入膜内。

在平衡时,Na+ 和CL-进出膜的速度应相等,则:
ν进=k进[Na]外.[Cl]外
ν出=k出[Na]内.[Cl]内
因 ν进=ν出,且k进=k出
故 [Na+]内.[Cl-]内=[Na+]外.[Cl-]外
将相应浓度代入上式:x(c1+x)=(c2-x)2
整理后,得:
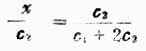
左边的x/c2说明膜外电解质进入膜内的百分率,称为扩散分数。
当c2c1,即外侧电解质过量时(c1可略去不计),则x/c2≈1/2说明电解质将平均分配在膜内外两侧。当 c2c1,即只有微量电解质时,x/c2≈0
(c2几乎等于零),说明电解质几乎留在外侧。
由此可见,在膜的一边存在的不能透过膜的高分子离子,对膜两侧的电解质浓度分布有很大的影响。当膜内高分子离子浓度很大时,电解质在膜两侧浓度分布的差值也很大。这时就表现为膜对Na++CL-好象完全不能透过,从而纠正了单纯从膜孔大小来解释生理上细胞膜对离子有选择透过性的看法。但是生物体内的活细胞膜的结构比较复杂,活细胞处于不断代谢过程中,故生物细胞膜是一种动态的体系,其组成、结构和性质也可随时改变,因此,在研究生理上膜的作用时,不能把它当作一种简单的半透膜来对待。
| 关于“医用化学/高分子化合物溶液”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |