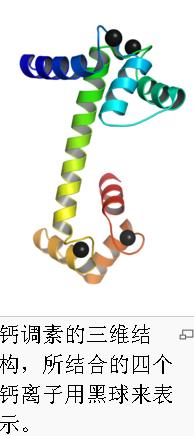
钙调蛋白
| A+医学百科 >> 钙调蛋白 |
钙调蛋白(calmodulin;CaM)一种能与钙离子结合的蛋白质。钙离子被称为细胞内的第二信使,其浓度变化可调节细胞的功能,这种调节作用主要是通过钙调素而实现的。钙调素是一种分子量为16700的单链蛋白质,由148个氨基酸组成。等电点为4.3,是酸性蛋白质。不同生物来源的钙调素,其氨基酸组成和顺序或完全一样,或仅有少许差异。它耐酸,耐热,十分稳定。钙调素和细胞内很多种酶的作用有关。在每个钙调素分子内,有4个可与钙离子结合的区域,它们的一级结构极为相似。细胞内钙离子水平通常维持在10-7摩尔浓度左右。当外来的刺激使细胞内钙离子的浓度瞬息间升高至10-6~10-5摩尔浓度时,钙调素即与钙离子结合,构象改变,螺旋度增加,成为活性分子,乃进而与酶结合,使之转变成活性态。当钙离子浓度低于10-6摩尔浓度时,钙调素就不再与钙离子结合,钙调素和酶都复原为无活性态。因此,可以根据钙离子浓度的变化来控制细胞内很多重要的生化反应。至1982年,已得到电鳗和鸡的钙调素cDNA克隆和鸡的钙调素基因克隆。根据前二者的核苷酸顺序分析,得知尽管它们的差异较大,但由之推测出的氨基酸顺序仍基本相同。在鸡的天然基因中,测得7个内含子,基因总长为12kb。在细胞分裂周期中,和细胞癌变时,钙调素基因的表达加强。
钙调蛋白是真核生物细胞中的胞质溶胶蛋白,由148个氨基酸组成单条多肽,相对分子质量为16.7kDa。
钙调蛋白的外形似哑铃,有两个球形的末端,中间被一个长而富有弹性的螺旋结构相连,每个末端有两个Ca2 结构域,每个结构域可以结合一个Ca2 , 这样,一个钙调蛋白可以结合4个Ca2 ,钙调蛋白与Ca2 结合后的构型相当稳定。在非刺激的细胞中钙调蛋白与Ca2 结合的亲和力很低;然而,如果由于刺激使细胞中Ca2 浓度升高时, Ca2 同钙调蛋白结合形成钙-钙调蛋白复合物(calcium-calmodulin complex),就会引起钙调蛋白构型的变化,增强了钙调蛋白与许多效应物结合的亲和力。
钙调蛋白是一种钙结合蛋白,存在于几乎所有的真核细胞中。它的作用是对任何微量的钙都能敏感地捕获。钙调蛋白只有在与Ca2+结合后才有活性。因此,激素可以通过影响细胞内Ca2+浓度变化来调控钙调蛋白的活性。活性Ca2+.CaM复合物可以通过与靶酶作用方式调控代谢过程。即Ca2+.CaM复合物与靶酶,如磷酸二酯酶、蛋白激酶等作用,使靶酶构象发生变化(Ca2+作用结果)而活化,从而对代谢过程起调控作用。
是一种能与钙结合而起着调节细胞功能作用的蛋白质。在真核生物中广泛存在。与钙结合后,CaM发生构型上的变化,成为一些酶的激活物。再与酶结合时,又引起酶的构型变化,使由非活性态转为活性态,CaM-Ca2+成了这些酶作用时必不可缺的成分。CaM参与的生化反应很多,涉及不少关键性的酶,如:控制信息传递中,第二信使cAMP合成与分解的腺苷酸环化酶和磷酸二酯酶;在糖原合成与分解中能提供和储存能量的磷酸化酶激酶和糖原合酶激酶,与蛋白质磷酸化及脱磷酸化有关蛋白激酶和蛋白磷酸解酶,能调节细胞内钙离子浓度,起着钙泵作用的Ca2+-ATPase,还有与平滑肌收缩有关的肌球蛋白轻链激酶等。CaM是由148个氨基酸组成的单链蛋白质,有四个Ca2+结合区,缺乏种属和组织特异性。不同来源,包括动物、植物以及低级真核生物所得到的CaM的氨基酸组成及排列基本相同。另外肽链中没有Cys和Pro-OH,因此在结构上有极大的灵活性。
| 关于“钙调蛋白”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |