氢氧化钙
| A+医学百科 >> 氢氧化钙 |
目录 |
简介
产品名称: 氢氧化钙
颜色:白色粉末状固体.
溶解性:微溶于水。
产品英文名 Calcium hydroxide;Hydrated lime;Slaked lime;Lime,hydrated,limewater
产品别名: 消石灰 ; 熟石灰
分子式 :Ca(OH)2
制备方法:CaO+H2O=Ca(OH)2
产品用途
用于制漂白粉, 检验CO2气体,硬水软化剂,改良土壤酸性,自来水消毒澄清剂及建筑工业等
毒性防护
其粉尘或悬浮液滴对粘膜有刺激作用,能引起喷嚏和咳嗽,和碱一样能使脂肪乳化,从皮肤吸收水分、溶解蛋白质、刺激及腐蚀组织。吸入石灰粉尘可能引起肺炎。 最高容许浓度为5mg/m3。 吸入粉尘时,可吸入水蒸气、可待因及犹奥宁,在胸廓处涂芥末膏;当落入眼内时,可用流水尽快冲洗,再用5%氯化铵溶液或0.01%CaNa2-EDTA溶液冲洗,然后将0.5%地卡因溶液滴入。工作时应注意保护呼吸器官,穿戴用防尘纤维制的工作服、手套、密闭防尘眼镜,并涂含油脂的软膏,以防止粉尘吸入。
包装储运
用内衬聚乙烯塑料薄膜袋的塑料编织袋包装,每袋净重25kg。应贮存在干燥的库房中。严防潮湿。避免与酸类物质共贮混运。运输时要防雨淋。失火时,可用水,砂土或一般灭火器扑救。
物化性质
细腻的白色粉末。相对密度2.24。加热至580℃脱水成氧化钙,在空气中吸收二氧化碳而成碳酸钙。溶于酸、铵盐、甘油,微溶于水,不溶于醇,有强碱性,对皮肤、织物有腐蚀作用。
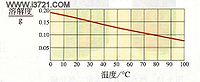
水中溶解度
0℃ 0.18g
10℃0.17g
20℃0.16g
30℃0.15g
40℃0.14g
50℃0.13g
60℃0.12g
70℃0.105g
80℃0.095g
90℃0.08g
100℃0.07g
质量标准 美国军用标准 O-C-110C (1984)
分子量 74.09
结构式 Ca(OH)2
消耗定额 石灰消化法
石灰石 (CaCO3 98%) 1.35
焦炭 0.18
其他相关
日本 石灰消化法
生石灰 (CaO 100%) 0.840
专业法定编号
制备方法
国际储运号
主要化学方程式有:
Ca(OH)2 + Na2CO3=2NaOH+CaCO3↓,这个反应可以用来制取小量烧碱。
氢氧化钙和二氧化碳的反应
Ca(OH)2+CO2=CaCO3↓+H2O(这是石灰浆涂到墙上后氢氧化钙与二氧化碳发生的反应,墙会“冒汗”就是因为生成了水H2O,墙变得坚固是因为生成了碳酸钙CaCO3,在乡下有时为了使墙更快变硬,就在刚刷好的屋里烧炭生成二氧化碳CO2(C+O2=(点燃)CO2)。这个反应也是检验CO2的方程式,气体通入石灰水变混浊的是CO2)。
氢氧化钙和二氧化碳的反应可用于*初中阶段*检验CO2
Ca(OH)2+CO2=CaCO3↓+H2O
但如果CO2过量沉淀会溶解
CaCO3+CO2+H2O=Ca(HCO3)2 ---------Ca(HCO3)2(碳酸氢钙易溶于水)
不同量的氢氧化钙和碳酸氢钠的反应
2NaHCO3+Ca(OH)2(少量)=CaCO3↓+2H2O+Na2CO3
NaHCO3+Ca(OH)2(过量)=CaCO3↓+H2O+NaOH
工业上煅烧石灰石CaCO3==(高温)CaO+CO2↑(此反应也是工业上制取大量CO2的方法,一式二用)
工地上经常冒白烟是在制石灰浆Ca(OH)2:CaO+H2O=Ca(OH)2(因为熟石灰的溶解度随温度升高而降低,所以工人更愿意在夏天制石灰浆,这样温度高时溶进水的熟石灰少,可制得更多石灰浆,此反应放出大量热量)
石灰浆(石灰浆,熟石灰即Ca(OH)2)被抹在墙上,与CO2反应后变硬Ca(OH)2+CO2=CaCO3↓+H2O
氟化氢氨与氢氧化钙的化学方程式:NH4HF2 + Ca(OH)2 = CaF2 + 2H2O +NH3
氯化镁和氢氧化钙反映的化学方程式:MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓
硝酸氨与氢氧化钙反应的化学方程式:
2NH4NO3+Ca(OH)2=NH3↑+H2O+Ca(NO3)2
(NH4)2SO4+Ca(OH)2=NH3↑+H2O+CaSO4
CaCO3+SiO2=CaSiO3+CO2 条件是高温
氢氧化钙具有碱的通性,是一种强碱。氢氧化钙的碱性比氢氧化钠强(金属活动性钙>钠),但由于氢氧化钙的溶解度比氢氧化钠小得多,所以氢氧化钙溶液的腐蚀性和碱性比氢氧化钠小。这些性质决定了氢氧化钙有广泛的应用。农业上用它降低土壤酸性,改良土壤结构,很明显在这种场合用氢氧化钠是不可能的。农药波尔多液是用石灰乳和硫酸铜水溶液按一定比例配制的。因1885年首先用于法国波尔多城而得名。这种用于果树和蔬菜的天蓝色粘稠的悬浊液农药,是通过其中的铜元素来消灭病虫害的。其中不仅利用了氢氧化钙能与硫酸铜反应的性质,也利用了氢氧化钙微溶于水的特点使药液成粘稠性,有利于药液在植物枝叶上附着。另外氢氧化钙与空气中的二氧化碳反应生成难溶于水的碳酸钙,也有利于药液附着于植物表面一段时间不被雨水冲掉。
氢氧化钙和二氧化碳的反应不论在化学实验室还是在工农业生产中,或者在自然界都经常发生。经常被利用着。石灰沙浆砌砖抹墙的事实熟为人知。鲜为人知的是制糖工业中也发生这个反应:在制糖过程中要用氢氧化钙来中和糖浆里的酸,然后再通入二氧化碳使剩余的氢氧化钙变成沉淀过滤出去,这样才能减少糖的酸味。
氢氧化钙溶液和饱和碳酸钠溶液反应能够生成氢氧化钠:
Ca(OH)2 + Na2CO3=2NaOH+CaCO3↓,这个反应可以用来制取小量烧碱。
Ca(OH)2+CO2=CaCO3↓+H2O ,这个反应可用来鉴定氢氧化钙溶液。
如果在氢氧化钙溶液中继续通入二氧化碳,会发下溶液先浑浊后澄清,这是因为二氧化碳会和碳酸钙[Ca(CO3)]继续反应
CaCO3+CO2+H2O=Ca(HCO3)2, 而碳酸氢钙[Ca(HCO3)2]是易溶的,所以溶液会再次澄清。加热溶液又变浑浊,因为碳酸氢钙受热分解
Ca(HCO3)2==CaCO3↓+CO2↑+H2O
氢氧化钙不能盛放在带玻璃塞的试剂瓶中,因为虽然二氧化硅化学性质稳定,但是会与强碱反应,如NaOH,KOH,RbOH,Ba(OH)2,Ca(OH)2。如果把氢氧化钙
放在带玻璃塞的试剂瓶中,会发生如下反应:
Ca(OH)2+SiO2===CaSiO3↓+H2O
而硅酸钙会沉淀在瓶塞上,导致瓶子打不开,所以不能盛放在带玻璃塞的试剂瓶中。
制取氢氧化钙:H2O+CaO=Ca(OH)2(这里切记!没有沉淀符号的)
初中需掌握的并不多:
Ca(OH)2+CO2=CaCO3↓+H2O
Ca(OH)2 + Na2CO3=2NaOH+CaCO3↓
Ca(OH)2+2HCl=CaCl2+2H2O
| 关于“氢氧化钙”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |