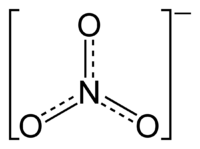
硝酸盐
| A+医学百科 >> 硝酸盐 |
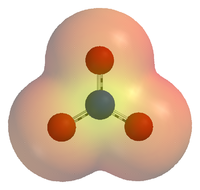
硝酸根离子的静电势能图,可以看出氧原子聚集了大部分的负电荷。
硝酸盐是硝酸根离子NO3−形成的盐。许多金属都能形成硝酸盐,包括无水盐或水合物。
目录 |
结构
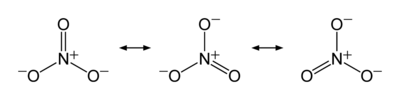
与碳酸根离子类似,硝酸根离子的分子构型是平面三角形,并且具有以下共振式:
合成
硝酸与金属、金属氧化物或碳酸盐反应是最简单的制备硝酸盐的方法。某些含水的硝酸盐如Be(NO3)2,Mg(NO3)2和Cu(NO3)2加热后会分解 ,因此得不到相应的无水硝酸盐。无水硝酸盐可通过下列途径制得:[1]
- 在液态N2O4中反应:
-
- Ni(CO)4 + N2O4 → Ni(NO3)2 + 2NO + 4CO
- 在纯HNO3-N2O5或液态N2O5中反应:
-
- TiCl4 + 4N2O5 → Ti(NO3)4 + 2N2O4 + 2Cl2
-
- TiCl4 + 4ClNO3 −(-80℃)→ Ti(NO3)4 + 2Cl2
某些金属还可形成通式为MOx(NO3)y的碱式硝酸盐,如BiO(NO3)2。
分解
硝酸盐分解的产物可以是:
括号中的信息按金属活动性顺序表排序
检验
硝酸根离子可在酸性介质中,通过和铁(II)反应产生棕色环加以定性检出。参见棕色环实验。
总反应为:
-
- 3Fe2+ + NO3− + 4H+ → 3Fe3+ + NO + 2H2O
虽然该反应已有很久的历史,但其机理却是不久前经分光光度法及电位滴定法的系统研究后才弄清楚的:[2]
-
- Fe2+ + NO3− + 2H+ → Fe3+ + NO2 + H2O
- Fe2+ + NO2 + H+ → Fe3+ + HNO2
- Fe2+ + HNO2 + H+ → Fe3+ + NO + H2O
- Fe2+ + NO → FeNO2+
- 2NO2 + H2O → HNO2 + NO3− + H+
- 2HNO2 → NO + NO2 + H2O
- NO + NO3− + H+ → NO2 + HNO2
其中棕色环是由FeNO2+(第四步)引起的,速控步则是最后一步。
配位化合物
硝酸根和金属离子可以按多种方式配位,包括单齿、双齿、叁齿或端梢、桥式等。
参见
参考资料
- ↑ 张青莲等。《无机化学丛书》第四卷 氮磷砷分族。北京:科学出版社。
- ↑ I. R. Epstein, K. Kustin and L. J. Warshaw, J. Am. Chem. Soc. 102:3751 (1980).
参考来源
出自A+医学百科 “硝酸盐”条目 http://www.a-hospital.com/w/%E7%A1%9D%E9%85%B8%E7%9B%90 转载请保留此链接
| 关于“硝酸盐”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |