医用化学/共轭酸碱的强弱
| 医学电子书 >> 《医用化学》 >> 电解质溶液 >> 酸碱质子理论 >> 共轭酸碱的强弱 |
| 医用化学 |
|
|
共轭酸碱对的离解常数Ka和Kb之间有确定的关系。以HOAc为例推导如下:
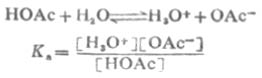
由于溶剂水的浓度不常数,所以它不出现在平衡常数式中。
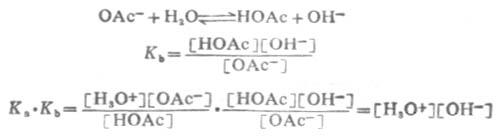
用KW表示[H3O+][OH-],KW称为水的离子积。这说明在一定温度下,水中的[H3O+]与[OH-]的乘积为一常数。所以 Ka.Kb=KW (2-7)
24℃时KW值为1.0×10-14.这个关系说明,只知道了酸的离解常数Ka,就可以计算出它的共轭碱的Kb,反之亦然。Ka和Kb是成反比的,而Ka和Kb正是反映酸和碱的强度,所以,在共轭酸碱对中,酸的强度愈大,其共轭碱的强度愈小;碱的强度愈大,其共轭酸的强度愈小。表2-6列出了一些共轭厔碱对的强度次序。
表2-6 共轭酸碱的强度次序
| 酸性增强 | 共轭酸(HB) | Ka(在水中) | pKa(在水中) | 共轭碱(B) |
碱性增强 |
| H3O+ | H2O | ||||
| H2C2O4 | 5.4×10-2 | 1.27 | HC2O-4 | ||
| H2SO3 | 1.54×10 | 1.81 | HSO-3 | ||
| HSO-4 | 1.20×10-2 | 1.92 | SO2-4 | ||
| H3PO4 | 7.51×10-3 | 2.12 | H2PO-4 | ||
| HNO2 | 4.6×10-4 | 3.37 | NO-2 | ||
| HF | 3.53×10-4 | 3.45 | F- | ||
| HCOOH | 1.77×10-4 | 3.75 | HCOO- | ||
| HC2O-4 | 5.4×10-5 | 4.27 | C2O2-4 | ||
| CH3COOH | 1.76×10-5 | 4.75 | CH3COO- | ||
| H2CO3 | 4.30×10-7 | 6.37 | HCO-3 | ||
| HSO-3 | 1.02×10-7 | 6.91 | SO2-3 | ||
| H2S | 9.1×10-8 | 7.04 | HS- | ||
| H2PO-4 | 6.23×10-8 | 7.21 | HPO2-4 | ||
| NH+4 | 5.68×10-10 | 9.25 | NH3 | ||
| HCN | 4.93×10-10 | 9.31 | CH- | ||
| HCO-3 | 5.61×1011 | 10.25 | CO2-3 | ||
| H2O2 | 2.4×10-12 | 11.62 | HO-2 | ||
| HS- | 1.1×10-12 | 11.96 | S2- | ||
| HPO2-4 | 2.2×10-13 | 12.67 | PO3-4 | ||
| H2O | OH- |
根据酸碱质子理论,酸碱在溶液中所表现出来的强度,不仅与酸碱的本性有关,也与溶剂的本性有关。我们所能测定的是酸碱在一定溶剂中表现出来的相对强度。同一种酸或碱,如果溶于不同的溶剂,它们所表现的相对强度就不同。例如HOAc在水中表现为弱酸,但在液氨中表现为强酸,这是因为液氨夺取质子的能力(即碱性)比水要强得多。这种现象进一步说明了酸碱强度的相对性。
出自A+医学百科 “医用化学/共轭酸碱的强弱”条目 http://www.a-hospital.com/w/%E5%8C%BB%E7%94%A8%E5%8C%96%E5%AD%A6/%E5%85%B1%E8%BD%AD%E9%85%B8%E7%A2%B1%E7%9A%84%E5%BC%BA%E5%BC%B1 转载请保留此链接
| 关于“医用化学/共轭酸碱的强弱”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |