三磷酸腺苷合酶
| A+医学百科 >> 三磷酸腺苷合酶 |
三磷酸腺苷合酶或ATP合酶,三磷酸腺苷酶(ATPase)的一种,在这里并特指F类的FoF1ATP合酶(F Type FoF1 ATP Synthase)。它利用呼吸链产生的质子的电化学势能,通过改变蛋白质的结构来进行ATP的合成。
| ATP合酶 | |||||||
|---|---|---|---|---|---|---|---|
|
|||||||
| 识别码 | |||||||
| EC编号 | 3.6.3.14 | ||||||
| CAS号 | 9000-83-3 | ||||||
| 数据库 | |||||||
| IntEnz | IntEnz浏览 | ||||||
| BRENDA | BRENDA入口 | ||||||
| ExPASy | NiceZyme浏览 | ||||||
| KEGG | KEGG入口 | ||||||
| MetaCyc | 代谢路径 | ||||||
| PRIAM | 概述 | ||||||
| PDB | RCSB PDB PDBe PDBsum | ||||||
| 基因本体 | AmiGO / EGO | ||||||
|
|||||||
目录 |
分布
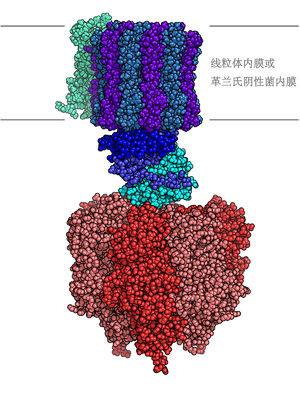
FoF1三磷酸腺苷合酶分子模型
通过使用电子显微镜,蘑菇状的F型ATP酶可以在真核细胞的粒线体内膜和原核生物的细胞膜上观察到。
位置
在真核细胞中,ATP合酶存在于线粒体的内膜或,Fo亚单位存在于膜内,F1
- F型ATP酶(ATPase)– 也称为‘Phosphorylation Factor’存在在各种生物中,利用电化学势进行ATP的合成。
- P型ATP酶(也称 E1-E2 ATP酶)– 存在在细菌,和真核细胞中,消费ATP进行离子运输。
- V型ATP酶 – 存在在液泡(Vesicle),如高尔基体,溶酶体上,消费ATP进行离子运输
- A型ATP酶 – 存在在古细菌(Archaea)中,虽然有F型ATP酶类似的功能--ATP合成,但是在结构上其更接近与V型ATP酶,反映了古细菌为适应极端条件的进化。
结构
当前,原核生物的F型ATP酶的结构已经比较清楚了:
- F1单元 – α(3个)、β(3个)、γ(1个)、δ(1个)、ε(1个)
- Fo单元 – a(1个)、b(2个)、c(9-12个)
真核生物的F型ATP酶F1单元的种类的数量与原核生物相同、Fo单元的结构与原核生物相似,但是亚单位的数量不是很明了。
ATP合酶的反应
F1 单元催化以下ATP合成反应。
F1单元催化的反映是可逆的,在进行离子运输时,进行ATP水解反应。
Fo单元形成离子通道,质子可以从中通过:
- H+in
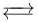 H+out
H+out
当质子利用电化学势能通过Fo单元时,可以带动和其连接的轴(γ亚单位),改变F1单元的结构,进而调节F1单元与ATP和ADP:Pi的结合能(Binding Energy),降低ATP生成的活化能,达到ATP合成的目的:
- ADP + Pi + 3 H+out → ATP + 3 H+in
ATP酶γ亚单位的旋转
在ATP酶的酶学模型中,验证其γ轴是否旋转占有重要地位,1997年,英国自然杂志(vol. 386, pp. 299–302)刊了日本科学家题为"Direct observation of the rotation of F1-ATPase"的文章,报道了ATP合成酵素F1单元可以通过水解ATP造成γ亚单位(轴)的旋转,并进行了单分子观察和录像、该论文证明了Paul D. Boyer的“ATP合酶的旋转理论”。同年Paul D. Boyer,John E. Walker和Jens C. Skou因ATP合酶的研究获得诺贝尔化学奖。
歴史
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||
参考来源
出自A+医学百科 “三磷酸腺苷合酶”条目 http://www.a-hospital.com/w/%E4%B8%89%E7%A3%B7%E9%85%B8%E8%85%BA%E8%8B%B7%E5%90%88%E9%85%B6 转载请保留此链接
| 关于“三磷酸腺苷合酶”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |