酶动力学
| A+医学百科 >> 酶动力学 |
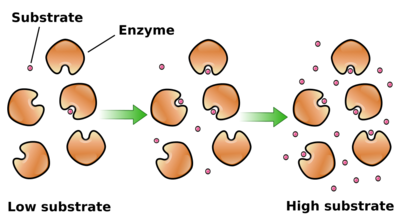
酶动力学,又被称为酶催化动力学、酶反应动力学或酵素动力学,是研究酶催化的化学反应速率的学科。酶动力学对于某一特定酶的研究,可以提供许多重要信息。如该种酶的催化机理、在代谢途径中的作用、其在细胞中的活性如何被调控以及相关药物和毒药如何抑制其活性。
目录 |
历史
1902年,维克多·亨利(Victor Henri)提出了对酶动力学进行定量的理论,[1]但是由于忽略了溶液中氢离子浓度的影响,他的实验结果无法验证这一理论。在1909年,Peter Lauritz Sørensen提出了对数的pH尺度并引入“缓冲”这一概念后,[2]德国化学家Leonor Michaelis和他的加拿大博士后Maud Leonora Menten重复了Henri的实验,实验结果肯定了Henri所提出的方程。这一方程被称为Henri-Michaelis-Menten kinetics或Michaelis-Menten kinetics,中文对应名称为米氏方程。[3]这一工作被G. E. Briggs和J. B. S. Haldane所进一步发展,此二人所提出的动力学方程至今仍得到广泛使用。[4]
多层基板的反应
多层基板的反应,后续复杂的速率方程描述如何衬底的约束,以及以何种顺序。
化学机理
一个很重要的目的测量酶动力学是确定化学机制的一种酶反应,即该序列的化学步骤变换到基板产品。
酶抑制
酶抑制剂的研究人员认为,减少或取消酶活性。这些都是可逆 (即取消该抑制剂恢复酶活性) 或不可逆(即抑制剂永久失活酶)。
参看
参考文献
- ↑ Henri,V.. Theorie generale de l'action de quelques diastases. Compt. rend. hebd. Acad. Sci. Paris. 1902, 135: 916-919.
- ↑ Sørensen,P.L.. Enzymstudien {II}. Über die Messung und Bedeutung der Wasserstoffionenkonzentration bei enzymatischen Prozessen. Biochem. Z.. 1909, 21: 131-304.
- ↑ Michaelis L., Menten M.. Die Kinetik der Invertinwirkung. Biochem. Z.. 1913, 49: 333–369. English translation Accessed 6 April 2007
- ↑ Briggs G. E., Haldane J. B. S.. A note on the kinetics of enzyme action. Biochem. J.. 1925, 19: 339–339. PMID 16743508.
进阶阅读
- Athel Cornish-Bowden, Fundamentals of Enzyme Kinetics. (3rd edition), Portland Press 2004, ISBN 1-85578-158-1.
- Irwin H. Segel, Enzyme Kinetics : Behavior and Analysis of Rapid Equilibrium and Steady-State Enzyme Systems. Wiley-Interscience; New Ed edition 1993, ISBN 0-471-30309-7.
- Alan Fersht, Structure and Mechanism in Protein Science : A Guide to Enzyme Catalysis and Protein Folding. W. H. Freeman, 1998. ISBN 0-7167-3268-8
- Santiago Schnell, Philip K. Maini, A century of enzyme kinetics: Reliability of the KM and vmax estimates, Comments on Theoretical Biology 8, 169–187, 2004 DOI: 10.1080/08948550390206768
- Chris Walsh, Enzymatic Reaction Mechanisms. W. H. Freeman and Company. 1979. ISBN 0-7167-0070-0
- Nicholas Price, Lewis Stevens, Fundamentals of Enzymology, Oxford University Press, 1999. ISBN 0-19-850229-X
- Tim Bugg, An Introduction to Enzyme and Coenzyme Chemistry Blackwell Publishing, 2004 ISBN 1-4051-1452-5
外部连结
- Animation of an enzyme assay - Shows effects of manipulating assay conditions
- MACiE - A database of enzyme reaction mechanisms
- ENZYME - Expasy enzyme nomenclature database
- ExCatDB - A database of enzyme catalytic mechanisms
- BRENDA - Comprehensive enzyme database, giving substrates, inhibitors and reaction diagrams
- SABIO-RK - A database of reaction kinetics
- Joseph Kraut's Research Group, University of California San Diego - Animations of several enzyme reaction mechanisms
- Symbolism and Terminology in Enzyme Kinetics - A comprehensive explanation of concepts and terminology in enzyme kinetics
- An introduction to enzyme kinetics - An accessible set of on-line tutorials on enzyme kinetics
- Enzyme kinetics animated tutorial - An animated tutorial with audio
|
||||||||||||||
参考来源
出自A+医学百科 “酶动力学”条目 http://www.a-hospital.com/w/%E9%85%B6%E5%8A%A8%E5%8A%9B%E5%AD%A6 转载请保留此链接
| 关于“酶动力学”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |