医用化学/脂环烃
| 医学电子书 >> 《医用化学》 >> 环烃 >> 脂环烃 |
| 医用化学 |
|
|
脂环烃是具有链烃性质的环烃。脂环烃及其衍生物广泛存在于自然界中,例如有些地区所产的石油中含多量的环烷烃;一些植物中含有的挥发油(精油),其成分大多是环烯烃及其含氧衍生物。挥发油是中草药中重要的有效成分,有的可作香料。在自然界广泛存在甾族化合物都是脂环烃的衍生物,在人体中起重要作用。
一、脂环烃的分类和命名
脂环烃分为饱和环烃和不饱和脂环烃。饱和脂环烃称为环烷烃;不饱脂环烃又分为环烯烃和环炔烃。环烷烃和环烯烃较多见,环炔烃则较少见。依环数多少又可把脂环烃分为单环脂烃和多环脂烃。
环烷烃中只有一个碳环的称为单环烷烃,它的通式为CnH2n,与单烯烃互为同分异构体。单环烷烃可分为大环(环上的碳原子数≥12)、中环(8~11个碳)、普通环(5~7个碳)和小环(3~4个碳)。到目前为止,已知的大环有三十碳环,最常见的是五碳环(环戊烷)和六碳环(环己烷)。
单环烷烃的命名是根据组成环的碳原子数为环某烷。例如:
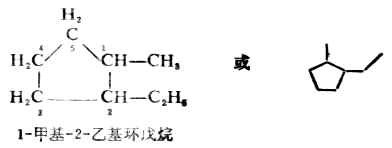
环上如有取代基时,取代基的位次尽可能采用最小数标出;若有不同取代基时,则以含碳最少的取代基作为1位。例如:
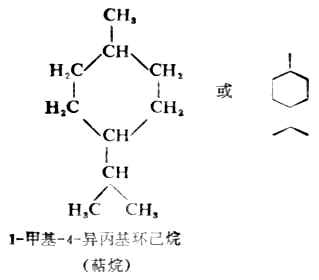
单环烯烃的命名,称为环某烯。标明双键位置以最小的数为原则。若有取代基时,取代基的位置数则以双键为准依次排列。例如:
脂环烃中具有几个环(常见的为双环)且共用一个、两个或两个以上碳原子的叫做多环脂烃。
二、环烷烃的结构
环烷烃中的碳原子也是sp3杂化的,它们的杂化轨道之间的夹角应为109°28′。但环丙烷的三个碳原子在一个面上,C-C间的sp3杂化轨道没有在两原子核连线的方向上重叠,也就是没有达到最大程度的重叠,如图12-1。所以分子内存在一种达到最大重叠的倾向,这种倾向就叫做“张力”。因此内能较高,环不稳定。环丁烷的情况与环丙烷相似,分子中也存在着张力,但比环丙烷要稳定得多。
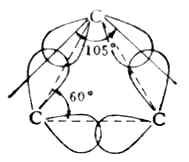
图13-1 环丙烷中sp3杂化轨道重叠示意图
五个碳以上的环烷烃环上的碳的碳原子并不都在同一平面上,C-C键角为109°28′左右。例如环戊烷的组成环的五个碳中只有四个是处在同一个平面上,另一个碳在平面外。这样的结构在不断地翻动着,处于平面外的碳沿着环迅速地变换。因而环戊烷是一个有一只角向上的近平面结构。

环戊烷
环己烷有四个碳原子在一个面上,其它两个碳一个在此平面的上方,另一个在这个平面的下方(椅型);或者两个都在此平面的上方(船型)。
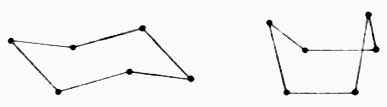
椅式 船式
环己烷的六个成环碳原子不共平面,C-C-C键角保持正常键角109°28′。通过键的扭动可 以得到椅型和船型两种不同的排列方式。
从不己烷的椅型构象和船型构象可以清楚地看出,椅型环己烷中所有相邻两个碳原子的碳氢键都处于正丁烷的邻位交叉式,非键合的C-1和C-3上的氢原子相距0.25nm,属于正常的原子间距。而船型环己烷的构象中,有两对碳原子(C-2与C-3;C-5与C-6)的键相互处于重叠式;同时又由于船头及船尾(C-1与C-4)的两个碳氢键是向内伸展的,相距较近,约0.183nm,比正常的非键合原子的间距小,故斥力较大,能量较高。实验证明,船型比椅型的能量高29.7kJ.mol-1左右。在常温下,环己烷是两种构象混合物,其中主要以椅型环己烷相聚在,船型只约占0.1%.
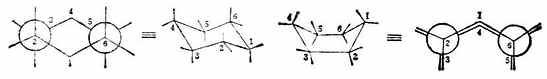
(纽曼投影式) (透视式) (透视式) (纽曼投影式)
椅型 (船型)
在椅型环己烷中,六个碳原子在空间分布于两个平面上,C-1、C-3、C-5在同一平面上,C-2、C-4、C-6在另一平面上。这样,环己烷中的十二个碳氢键可以分为两种类型,其中六个是垂直于平面而与对称轴平行的,叫直立键或a键,三个向上,三个向下,交替排列。另六个大致与环平面平行,实际与对称轴成±19.5°角,叫平伏键或e键(如图12-3).
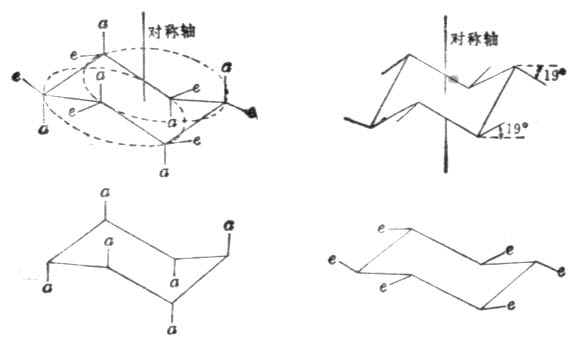
在室温下,环己烷的一种椅型构象,可以通过C-C键的扭动很快地转变为另一种椅型构象.这时原来的a键就变成了e键,原来的e键变成了a,但对应平面上下关系不变(图12-4)。

图12-4 两种椅型构象的转变
对环己烷来说,这两种构象可以相互转变,但环上有取代基时情况不同。
一元取代的环己烷,其取代基可以a键,也可以连在e键上,形成两种不同的构象。一般以e键取代的构象能量较低,比较稳定。这是因为e键上的取代基与环上同侧的两个a键上的氢原子距离较远,斥力较小,较为稳定。例如,甲基环烷在室温时,当取代基在a键上时,则与环上同侧的两个a键上氢的距离较近,斥力较大,故不稳定。甲基环烷在室温时,当取代基在a键 上时,则与环上同侧的两个a键上的氢的距离较近,斥力较大,故不稳定。甲基以e键连结的分子约占95%,而以a键连结的分子仅占5%,且存在如下的动态平衡:
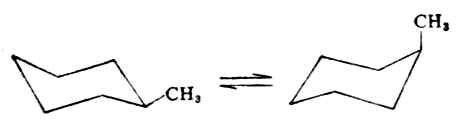
95%5%
当取代基越大时,这种以e键取代的构为主的趋势越大。
二元取代的环己烷可以有1-2-,1-3-和1.4-三种位置异构体,在每一种构体中,又有顺式与反式异构体。以1,2-二甲基环己烷为例,顺式异构体中两个甲基位于环平面的同侧,其相应的构象式为:
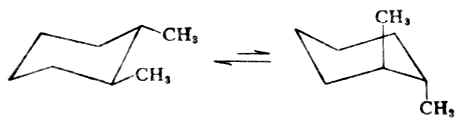
这两个构象式实际上是相同的,都是一个甲基连于e键,另一个甲基连于a键,能量相同,稳定性相同。
反式异构体中,两个甲基位于环的异侧,两个甲基可以都连在两个e键上(ee型),或都连于两个a键上(aa型)。显然ee型比较稳定。所以,反式1,2-二甲基环己烷主要以ee型的构象存在。
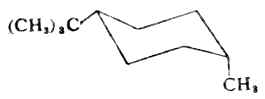
当两个取代基不相同时,如顺-1-甲基-4-叔丁基在e键,甲基在a键的构象为优势构象。

所以环己烷和取代环己烷的构象稳定性有如下规律:
①椅型构象比船型构象稳定。
②环己烷的一元取代物中,以e键取代物稳定;多元取代物中,以e-取代多的构象较稳定。
③环上有不同的取代基时,大的取代基结合在e键上的构象最稳定。
三、脂环烃的性质
(一)物理物质
脂环烃的物理性质与链烃相似。环丙烷和环丁烷在常温下是气体,环戊烷是液体,高级环烷烃是固体,如环三十烷的熔点为56℃。环烷烃的熔点、沸点和相对密度都比含同数碳原子的烷烃为高(表12-1)。
表12-1 一些环烷烃及烷烃的物理常数比较
| 化合物 | 熔点/℃ | 沸点/℃ | 相对密度(d204) |
| 环丙烷 | -127.6 | -32.9 | 0.720(-79℃) |
| 丙烷 | -187.69 | -42.07 | 0.5005(7℃) |
| 环丁烷 | -90 | 12.5 | 0.703(0℃) |
| 丁烷 | -138.45 | -0.5 | 0.5788 |
| 环戊烷 | -93.9 | 49.3 | 0.7454 |
| 戊烷 | -129.72 | 36.07 | 0.6262 |
| 环己烷 | 6.6 | 80.7 | 0.7786 |
| 己烷 | -95 | 68.95 | 0.6603 |
1.加氢
环烷烃可进行催化氢化反应,氢化时环被打开,两端碳原子与氢原子结合而生成链状的烷烃。在氢化过程中,由于环烷烃环的大小不同,反应的难易程度也不一样。
(二)化学性质
从化学键的角度来分析,环烷烃与烷烃相似;环烯烃和环炔烃分别与烯烃和炔烃相似。但是,由于脂环烃具有环状构造,小环烃出现的一些特殊的化学性质。主要表现在环的稳定性上,小环较不稳定,大环则较稳定。
1.加氢
环烷烃可进行催化氢化反应,氢化时环被打开,两端碳原子与氢原子结合而生成链状的烷烃。在氢化过程中,由于环烷烃环的大小不同,反应的难易程度也不一样。
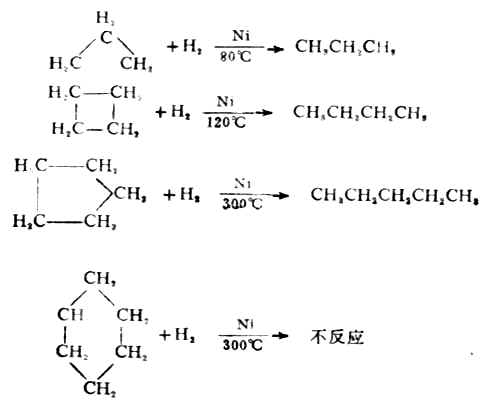
2.加卤素
环丙烷在常温下,环丁烷在加热时分别与氯或溴发生加成反应,开环得1,3-或1,4-二卤代烷。
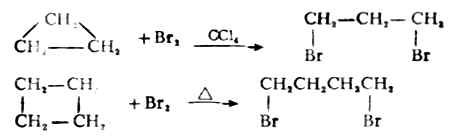
环戊烷及更高级的环烷烃与卤素不发生加成反应,而是进行自由基取代。例如:
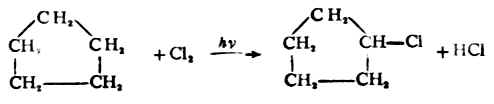
3.加氢卤酸
环丙烷在常温时与氢卤酸发生加成反应得卤丙烷。环上有烷基取代的环丙烷衍生物与氢卤酸的加成符合马氏规则。碳环打开,氢原子加在连氢较多的碳原子上,而卤原子则加在连氢较少的碳上。
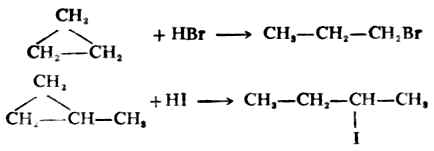
常温时,环丁烷、环戊烷及更高级的环烷烃与氢卤酸不起反应。
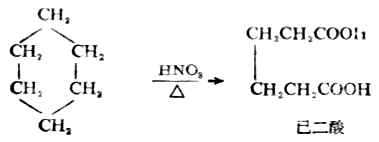
另外,若以强氧化剂在加热条件下与环烷烃作用时,则环断裂,生成二元羧酸。例如:
| 关于“医用化学/脂环烃”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |