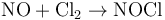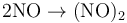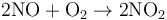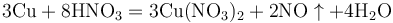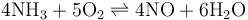一氧化氮
| A+医学百科 >> 一氧化氮 |
| 一氧化氮 | |
|---|---|
 |
|
 |
|
| IUPAC名 Nitric oxide |
|
| 识别 | |
| CAS号 | 10102-43-9 |
| 性质 | |
| 化学式 | NO |
| 摩尔质量 | 30.0061 g·mol⁻¹ |
| 外观 | 无色气体 |
| 密度 | (液) 1.3 × 103 kg m−3 (气) 1.34kg m−3 |
| 熔点 | −163.6°C (109.6 K) |
| 沸点 | −151.7°C (121.4 K) |
| 危险性 | |
| 欧盟危险性符号 |
|
| 警示术语 | R:R9-R23-R24-R25-R34-R44 |
| 安全术语 | S:S23-S36-S37-S39 |
| NFPA 704 | |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
一氧化氮是氮的化合物,化学式NO,分子量30,氮的化合价为+2。由于一氧化氮带有自由基,这使它个化学性质非常活泼。具有顺磁性。当它与氧反应后,可形成具有腐蚀性的气体——二氧化氮(NO2)。一氧化氮在标准状况下为无色气体,液态、固态呈蓝色。
目录 |
作用
一氧化氮起着信使分子的作用。当内皮要向肌肉发出放松指令以促进血液流通时,它就会产生一些一氧化氮分子,这些分子很小,能很容易地穿过细胞膜。血管周围的平滑肌细胞接收信号后舒张,使血管扩张。
一氧化氮也能在神经系统的细胞中发挥作用。它对周围神经末梢或许有所作用。
免疫系统产生的一氧化氮分子,不仅能抗击侵入人体的微生物,而且还能够在一定程度上阻止癌细胞的繁殖,阻止肿瘤细胞扩散。
一氧化氮对血管有三大作用:1、血管扩张 2、防止低密度脂蛋白(LDL)氧化,降低单核细胞黏附血管壁 3、降低血小板的黏稠度
结构
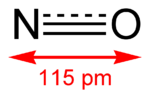
一氧化氮为双原子分子,分子构型为直线型。一氧化氮中,氮与氧之间形成一个σ键、一个2电子π键与一个3电子π键。氮氧之间键级为2.5,氮与氧各有一对孤对电子。有11个价电子,是奇电子分子,具有顺磁性。分子轨道式:
- (σ1s)2(σ1s*)2(σ2s)2(σ2s*)2(σ2p)2(π2p)4(π2p*)1
反键轨道上(π2p*)1易失去生成亚硝酰阳离子NO+:
可以二聚生成(NO)2,在固态中少量存在:
性质
还原性
一氧化氮易被氧化生成二氧化氮,处于空气中的一氧化氮很快会被空气中的氧气氧化生成红棕色二氧化氮。工业上可用此法生产硝酸。
制取
实验室用铜与稀硝酸共热制取一氧化氮:
工业上用氨气在铂(石棉载体)或铂铑合金网催化下氧化生成一氧化氮,这是工业上制硝酸的重要反应:
配位性
由于孤对电子的存在,一氧化氮易与金属离子形成配合物。可与血红蛋白结合,使人窒息中毒。
如一氧化氮可与Fe2+生成棕色亚硝酰亚铁离子,称为棕色环反应,为检验亚铁离子的反应之一:
- Fe2+ + NO + H2O → [Fe(H2O)5NO]2+
其中Fe为Fe(II)
NO可与过渡金属以端基、边桥基、面桥基形式配位。
生物活性
- 在心血管中,一氧化氮对维持血管张力的恒定与调节血压稳定起着重要作用。硝酸甘油治疗心绞痛正是由于其在体内转化成NO,扩张血管。
- 在免疫系统中,NO起杀伤细菌、病毒、肿瘤细胞的作用。
- 在神经系统中,一氧化氮促进学习、记忆过程,并可调节脑血流
参考来源
| 关于“一氧化氮”的留言: | |
|
目前暂无留言 | |
| 添加留言 | |